将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是


| A.硫酸铜的溶解度 | B.溶液的质量 |
| C.溶液中溶质的质量分数 | D.溶液中Cu 的数目 的数目 |
下列变化中属于化学变化的是( )
| A.碘的升华 | B.一束强光照射淀粉胶体出现光亮的通路 |
| C.NaCl在水中电离 | D.蓝色的胆矾常温下变白 |
向18mol·L-1的浓H2SO4溶液加入足量的铜片并加热,若被还原的H2SO4的物质的量为0.9mol,则所需的浓硫酸的体积 ( )
| A.等于50mL | B.等于100mL | C.大于100mL | D.大于50mL小于100mL |
依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
| A.依据元素的原子序数,推断该元素原子的核外电子数 |
| B.依据气体的摩尔质量,推断相同状况下不同气体密度的大小 |
| C.依据物质摩尔质量,推断物质熔、沸点的高低 |
| D.依据液体物质的沸点,推断用蒸馏法分离两种互溶液态物质组成的混合物的可行性 |
设NA为阿伏加德罗常数,下列叙述中不正确的是
| A.1LpH=1的甲酸溶液中,H+数目为0.1 NA |
| B.标准状况下,3.36L乙醇中含有的分子数为0.15 NA |
| C.1 mol甲基(-CH3)所含电子数9NA |
| D.1L 1mol/L的FeCl3溶液所含的Fe3+数目为NA |
下列化学用语正确的是( )
| A.乙烯分子的结构简式:CH2CH2 | B.氯化镁的电子式: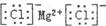 |
C.质量数为137的钡原子: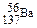 |
D.K+离子的结构示意图: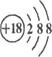 |
向体积为Va的0.05mol/L CH3COOH溶液中加入体积为Vb的0.05mol/LKOH溶液,下列关系错误的是:
| A.Va>Vb时:C(CH3COOH)+ C(CH3COO-)>C(K+) |
| B.Va=Vb时:C(CH3COOH)+ C(H+)="=" C(OH-) |
| C.Va<Vb时:C(CH3COO-)>C(K+)>C(OH-)>C(H+) |
| D.Va与Vb任意比时:C(K+)+C(H+)==C(OH-)+C(CH3COO-) |
往含有S2-和Cl-的稀溶液中逐滴加入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(S2-)/c(Cl-)的比值为:
| A.2V1/V2 | B.2(V2-V1)/V1 | C.2V2/V1 | D.V1/2(V2-V1) |
欲使0.1mol/L的稀氨水中,C(NH3·H2O)/C(OH-)逐渐减小,可采取的措施是:
| A.加入少量Al(OH)3固体 | B.加入少量NaOH晶体 |
| C.加入少量NH4Cl晶体 | D.继续加0.1mol/L的稀氨水 |
设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.1mol甲基正离子(CH3+)所含电子数为8NA |
| B.NA个H2分子的质量约为2g,它所占的体积约为22.4L |
| C.标准状况下,11.2LCHCl3中所含的分子数为0.5N |
| D.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5N |
将一定质量的Zn放入18mol/L的浓H2SO4中,充分反应后,共收集到标况下的气体4.48L,且1mol该气体的质量为48.5克。在反应后的溶液中,加入足量的BaCl2溶液,生成58.25克的沉淀。则求:
(1)所得气体的成份和各自的体积。
(2)所用Zn的质量。
(3)消耗浓H2SO4的体积为多少毫升(保留小数点一位)。
下列各组物质关系中,与O2和O3关系相同的一组是( )
| A.Na和Na+ | B.S4和S8 | C. H和 H和 H H |
D.H2O和D2O |