用98%的浓H2SO4(ρ=1.84g/cm3)配制成1.84mol/L的稀H2SO4 500ml,计算所需浓H2SO4的体积。(注意:要求写出简单的计算步骤。)
已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比.
将一定质量的Zn放入18mol/L的浓H2SO4中,充分反应后,共收集到标况下的气体4.48L,且1mol该气体的质量为48.5克。在反应后的溶液中,加入足量的BaCl2溶液,生成58.25克的沉淀。则求:
(1)所得气体的成份和各自的体积。
(2)所用Zn的质量。
(3)消耗浓H2SO4的体积为多少毫升(保留小数点一位)。
已知在T°C和一定压强下,往容积可变的密闭容器中充入2molSO2和1molO2,此时容器容积为VL,保持恒温恒压,使反应:2SO2(g)+O2(g)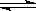 2SO3(g)在5min末达到平衡,测得SO3的体积分数为0.4;试回答下列问题:(1)平衡混合气体中SO2的体积分数为 ,平衡过程中O2的转化率为 ;(2)另选一容积固定不变的容器,仍控制温度为T°C,充入2molSO2和1molO2使反应,达到平衡时SO3的体积分数仍为0.4,则密闭容器的体积为: L。
2SO3(g)在5min末达到平衡,测得SO3的体积分数为0.4;试回答下列问题:(1)平衡混合气体中SO2的体积分数为 ,平衡过程中O2的转化率为 ;(2)另选一容积固定不变的容器,仍控制温度为T°C,充入2molSO2和1molO2使反应,达到平衡时SO3的体积分数仍为0.4,则密闭容器的体积为: L。