判断下列分子间能否形成氢键。
①HClO4 ②H2SO4 ③H3 PO4 ④HNO3 ⑤H2Se ⑥H3PO2 ⑦C2H5OH ⑧CH3 COOH ⑨H2 O2 ⑩HBrO3 ⑪NaOH
分)【化学选修
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中  键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离
子可以与上述元素中的三种形成的某阴离子生成血红色
络合物;该阴离子又与A-I元素中的某些原子形成的分
子互为等电子体,这种分子的化学式为____(写一种即
可).该阴离子空间构型为____。
(3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____.
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为 ;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。
[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有 个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。

四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式 。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是___________________________________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子 。
已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。

【物质结构与性质】
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)基态Cu原子的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示,该化合物的化学式为 。
判断下列四句话的对错,并且说出理由:
(1)离子键只存在于离子化合物中
(2)离子化合物一定含离子键
(3)离子化合物中一定不存在分子
(4)离子化合物不一定含有金属元素
(18分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子的空间构型为___________;水分子自身作用会生成阴、阳两种离子,其中阴离子的电子式是___________
(2)如图是某品牌饮用矿泉水标签的部分内容。请计算一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________。
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为b g·cm﹣3。用化学方程式表示氨气溶于水显碱性的原因___________该溶液的物质的量浓度为___________mol·L﹣1。
(4)已知M是生活中常见的一种金属,将44.8 g M完全溶于很稀的过量硝酸,向所得溶液中加入足量固体烧碱并加热,放出6.72 L(标准状况)气体。M溶于该很稀的硝酸的离子方程式为___________________。M与水在高温条件下,生成1g气体吸热a kJ,写出该反应的热化学方程式_________________________________。
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是_________________________________
②实验室中检验淀粉水解产物应选用的试剂可以是___________ (填字母)·
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
氮元素可形成叠氮化物及络合物等。
(1)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①写出与N3-互为等电子体的分子: ,N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。CN-中C原子的杂化类型是 。
(2)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |

(3)对氨基苯酚( )的沸点高于邻氨基苯酚(
)的沸点高于邻氨基苯酚( )的沸点(填:“大于”、“小于”、“等于”),理由是
)的沸点(填:“大于”、“小于”、“等于”),理由是
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: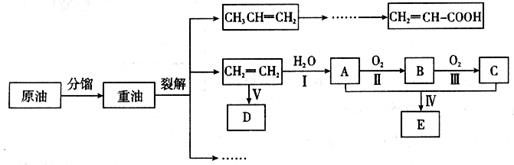
已知:
(1)写出A的电子式 。
(2)反应II的化学方程式是__________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(4)E是有香味的物质,在实验室用下图装置制取。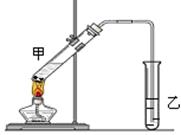
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是 。
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
Ⅰ.(6分)请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.(12分)化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
原子序数由小到大排列的四种短周期元素X、Y、 Z、W, 四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M完全燃烧生成的氧化物的电子式________,该氧化物与水反应的离子方程式________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为_______。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是_______(填化学式)。写出该气体B与氯水反应的离子方程式____________________。
(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。C的化学式为______________________________。