金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的
| A.Li Na K | B.Na Mg Al | C.Li Be Mg | D.Li Na Mg |
下列关于化学键的说法正确的是
| A.离子化合物中一定存在离子键,可能存在共价键 |
| B.由金属元素和非金属元素组成的化学键一定是离子键 |
| C.非极性键只存在于双原子单质分子中 |
| D.NH4Cl是一种共价化合物 |
标准状态下,气态分子断开l mol化学键的焓变称为键能。已知H-H、H-O和O=O键的键能ΔH分别为436 kJ/mol、463 kJ/mol和495kJ/mol。下列热化学方程式正确的是( )
A.H2O (g)= H2(g)+ O2(g);ΔH=" -485" kJ/mol O2(g);ΔH=" -485" kJ/mol |
| B.2H2(g)+ O 2(g)=2H2O(g)ΔH =" -485" kJ/mol |
| C.2H2(g)+ O2 (g)= 2H2O(g)ΔH =" +485" kJ/mol |
D.H2O (g)=H2(g)+ O2(g);ΔH="=+485" kJ/mol O2(g);ΔH="=+485" kJ/mol |
下列说法正确的是 ( )
| A.Na2O2、NaClO中所含化学键类型完全相同 |
| B.只有活泼金属元素与活泼非金属元素之间才能形成离子键 |
| C.等物质的量的CN-和N2含有的共用电子对数相等 |
| D.氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
下列物质:①BeCl2 ②SiC ③白磷 ④BF3 ⑤NH3 ⑥过氧化氢 , 其中含极性键的非极性分子是
| A.①③④ | B.②③⑥ | C.①④ | D.①③④⑤ |
下列叙述中,正确的是
| A.1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 |
| B.NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 |
| C.对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 |
| D.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |
下列有关判断化学基本概念的依据中,一定正确的是
| A.离子晶体:由阴阳离子构成的晶体 |
| B.共价化合物:含有共价键的化合物 |
| C.酸性:PH<7 |
| D.强电解质:能溶于水的化合物 |
下列有关化学用语表示正确的是
| A.二氧化硅的分子式:SiO2 |
B.熔融状态下硫酸氢钾的电离方程式:KHSO4 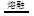 K++HSO4- K++HSO4- |
C.甲基的电子式: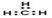 |
| D.HClO的结构式:H-Cl-O |
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
| A.NH4Cl=NH3↑+ HCl↑ | B.NH3+CO2+H2O=NH4HCO3 |
| C.2NaOH+Cl2=NaCl+NaClO+H2O | D.2Na2O2+2CO2=2Na2CO3+O2 |