甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |
最近,中国科大的科学家们将C60分子组装在一个单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图象.下列化合物分子中一定既含σ键又含π键的是
| A.N2 | B.CO2 | C.C2H4O | D.H2O2 |
三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是
| A.PCl3分子中三个共价键的键长,键角都相等 |
| B.PCl3分子中的P-Cl键属于极性共价键 |
| C.PCl3分子中三个共价键键能,键角均相等 |
| D.PCl3是非极性分子 |
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
A.A、D两种元素形成的化合物中只含有极性键
B.A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性
C.原子半径由大到小的顺序是F>E>C>D
D.最高价氧化物对应水化物酸性最强的元素是C
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大,下列说法正确的是( )
| A.M与X形成的化合物对应的水化物一定是强酸 |
| B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C.X、Y的简单离子半径:r(X2﹣)>r(Y+) |
| D.M的气态氢化物比X的气态氢化物稳定 |
下列化学用语使用正确的是
A.中子数为9的氧原子符号为16O
B.某元素的一种原子质量数为X则该元素的相对原子质量为X
C.H、D、T三种核素化学性质不相同
D.次氯酸的结构式:H—O—Cl
下列物质的熔点均按由高到低的次序排列,其原因是由于键能由大到小排列的是
| A.钠、干冰 | B.金刚石、晶体硅 |
| C.碘化氢、溴化氢 | D.二氧化硅、二氧化碳 |
分子模型可以直观地表现分子结构的特点。下图表示某烃分子的一种模型,有关说法中正确的是
| A.该图表示的是乙烯分子的球棍模型 |
| B.该烃分子是非极性分子 |
C.该烃的电子式为: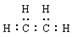 |
D.该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2 HCOONa+H2O,下列有关说法正确的是
HCOONa+H2O,下列有关说法正确的是
| A.储氢过程中,NaHCO3被氧化 |
| B.释氢过程的本质是盐类的水解 |
| C.储氢、释氢过程均无能量变化 |
| D.HCOONa晶体中既含有离子键又含有共价键 |
下列说法正确的是
| A.福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定高 |
| C.CO2、H2O、N2这些分子中所有原子都满足最外层为8电子的结构 |
| D.原子结构模型的演变经历了 : |

运用有关概念判断下列说法正确的是
| A.NH4Cl中有离子键,是离子化合物 |
| B.46g C2H5OH燃烧放出的热量为乙醇的燃烧热 |
C.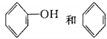 互为同系物 互为同系物 |
| D.绿色化学的核心是应用化学原理对环境污染进行治理 |
下列说法正确的是( )
| A.同一主族元素气态氢化物从上到下,其沸点逐渐升高 |
| B.非金属单质中一定存在共价键,离子化合物中可能存在共价键 |
| C.非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 |
| D.含有阴离子的物质一定含有阳离子 |