下列含有非极性键的离子晶体是 ( )
①醋酸钠固体 ②氢氧化钾固体 ③过氧化钠固体
④金刚石 ⑤固态乙醇 ⑥氯化钙固体
| A.③⑥ | B.①③ | C.③④⑤ | D.②⑥ |
以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象被化学家称为8-N规则。某非金属单质的结构如图所示,构成该单质的元素位于( )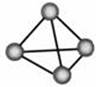
| A.第ⅢA族 | B.第ⅣA族 |
| C.第ⅤA族 | D.第ⅥA族 |
现有如下各种说法,正确的是 ( )
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤乙烯分子中C-C之间未参加杂化的2p轨道形成π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形
| A.①③⑤ | B.②⑥ | C.③⑤ | D.③④⑤ |
共价键、离子键、金属键、范德华力和氢键都是微观粒子之间的不同作用力,下列物质:①Na2O2;②冰;③金刚石;④碘单质;⑤CaCl2;⑥白磷,其中只含有两种作用力的组合是 ( )
| A.①④⑥ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |
下列离子中不存在配位键的是 ( )
| A.H3O+ | B.OH- | C.NH4+ | D.[Zn(NH3)4]2+ |
下列分子中含有两个π键的组合是 ( )
①N2 ②C2H4 ③CO2 ④CH≡CH ⑤CH3-CH2-OH
| A.①③④ | B.①②④ | C.③④⑤ | D.①②③ |
对应于下列物质中的中心原子的杂化轨道类型和分子的立体构型有错误的是( )
| A.BeCl2中的Be,sp,直线形 |
| B.SiF4中的Si,sp3,正四面体形 |
| C.BCl3中的B,sp2,平面三角形 |
| D.C6H6中的C,sp,平面正六边形 |
下列物质中,不含共价键的是( )
| A.NaCl | B.Cl2 | C.HCl | D.NaOH |
下例各组数值是相应元素的原子序数,其中所表示的原子能以离子键结合成稳定化合物的是
| A.1与6 | B.2与8 | C.9与11 | D.8与14 |
下列说法错误的是( )
| A.含有共价键的化合物一定是共价化合物 |
| B.在共价化合物中一定含有共价键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.双原子单质分子中的共价健一定是非极性键 |
下列说法中不正确的是( )
A含有离子键的化合物一定是离子化合物
B含有金属元素的化合物不一定是离子化合物
C含有共价键的化合物不一定是共价化合物
D在共价化合物中也可能含有离子键
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.在共价化合物分子内,一定不存在离子键 |
| D.由不同元素组成的多原子分子里,一定只存在极性键 |