下列叙述正确的是


| A.离子化合物中不可能含有共价键 | B.共价化合物中不可能含有离子键 |
| C.非极性分子中一定含有非极性键 | D.由极性键形成的分子一定是极性分子 |
现有如下各说法:
①在水分子中氢、氧原子间以共价键相结合
②活泼金属和活泼非金属化合时一般形成离子键;
③非金属元素间形成的化合物一定是共价化合物;
④根据电离方程式HCl = H+ + Cl-,判断HCl分子里存在离子键;
⑤冰的密度比水的密度小,这与氢键有关
上述各种说法正确的是
| A.①②⑤ | B.①②④⑤ | C.①②③④⑤ | D.①③④⑤ |
下列分子中所有原子都满足最外层为8电子结构的是
| A.BF3 | B.H2O | C.SiCl4 | D.PCl5 |
下列说法正确的是( )
| A.单质分子中一定存在共价键 |
| B.活泼金属与活泼非金属形成的化合物一定是离子化合物 |
| C.不同种类元素的原子间可能形成非极性键 |
| D.离子化合物中可能不含金属元素 |
离子键和共价键可能同时存在于同一化合物中。下列化合物中既存在离子键又存在共价键的是
| A.KBr | B.NaOH | C.HBr | D.NaCl |
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y 与Z
与Z 核外电子层的结构相同。下列化合物中同时存在离子键和共价键的是
核外电子层的结构相同。下列化合物中同时存在离子键和共价键的是
| A.Z2Y | B.Z2Y2 | C.X2Y2 | D.ZYX |
下列叙述正确的是
| A.离子化合物一定不含共价键 | B.共价化合物一定不含离子键 |
| C.气态单质的分子中一定存在共价键 | D.非金属元素的化合物一定不含离子键 |
下列关于化学键的说法中不正确的是
| A.化学键是一种作用力 |
| B.化学键可以使离子相结合,也可以使原子相结合 |
| C.化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成 |
| D.非极性键不是化学键 |
下列说法正确的是( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.NaCl和HCl溶于水时,克服粒子间作用力的类型相同 |
| C.24Mg32S晶体中电子总数与中子总数之比为1︰1 |
| D.H2S和SiF4分子中各原子最外层都满足8电子结构 |
下列物质中既含有离子键又含有共价键的是
| A.MgCl2 | B.NaOH | C.CH4 | D.H2O |
(11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(7) 第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
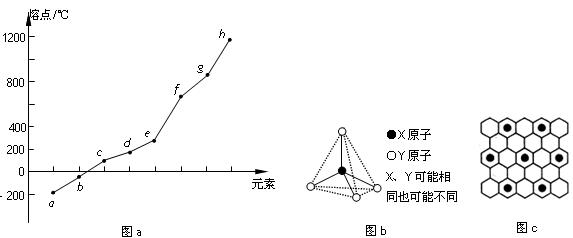
(8) 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 |
A |
B |
HF |
D |
E |
| 沸点/℃ |
1317 |
100 |
19.5 |
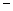 33.35 33.35 |
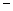 164 164 |
(9) 第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(10)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。