在NaF、NaOH、CaO、Cl2、NH4Cl、H2O2等物质中只含有离子键的物质有: ;只含有共价键的物质有: ;既含有离子键又含有共价键的物质有: ;属于离子化合物的有: ;属于共价化合物的有: 。
下列各组物质中,全部以共价键结合的是( )
| A.H2S、HNO3、CO2 | B.MgSO4、CaO、HCl |
| C.Na2S、NH4Cl、N2 | D.CO2、H2O、Na2O2 |
下列说法正确的是( )
| A.离子化合物中一定含有金属元素 | B.含有共价键的化合物一定是共价化合物 |
| C.离子化合物一定存在离子键 | D.CO2由固态变成气态时一定破坏共价键 |
下列的晶体中,化学键种类相同,晶体类型也相同的是
| A.SO2与SiO2 | B.CO2与H2O | C.NaCl与HCl | D.CCl4与KCl |
下列说法中,正确的是
| A.离子化合物中一定不含共价键,共价化合物中一定不含离子键 |
| B.水分子呈直线形,氨分子呈三角锥形 |
| C.碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键 |
| D.分子间作用力越大,分子的热稳定性就越大 |
I下列描述中正确的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)原子的核外电子排布式为;
(2)、
的晶体结构类型均与氯化钠的相同,
和
的离子半径分别为69
和78
,则熔点
(填"<"或">");
(3)晶胞中
和
的配位数分别为、;
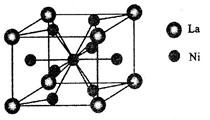
(4)金属镍与镧()形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;

(5)丁二酮肟常用于检验:在稀氨水介质中,丁二酮肟与
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是键,碳氮之间的共价键类型是,氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在;
 ③该结构中,碳原子的杂化轨道类型有。
③该结构中,碳原子的杂化轨道类型有。
实现下列变化时,需克服相同类型作用的是( )
| A.纯碱和烧碱的熔化 | B.水晶和干冰的熔化 |
| C.食盐和冰醋酸的熔化 | D.液溴和液汞的气化 |