S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
已知:C(s,石墨) ="=" C(s,金刚石) ΔH =" +1.9" kJ·mol-1。下列有关说法正确的是
| A.相同条件下,1 mol石墨比1 mol金刚石能量高 |
| B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少 |
| C.若:C(s,石墨) + O2(g)==CO2(g) ΔH1=-393.5 kJ•mol-1 则有:C(s,金刚石) + O2(g)==CO2(g)ΔH2=-395.4 kJ·mol-1 |
| D.其他条件不变时,加入合适的催化剂,可实现该反应的反应热转变为ΔH<0 |
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
① H2(g)+I2(?) 2HI(g)+9.48kJ② H2(g)+I2(?)
2HI(g)+9.48kJ② H2(g)+I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 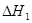 ="-443.64" kJ·mol-1
="-443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g) 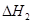 = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)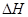 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |
下列有关热化学方程式的叙述正确的是( )
| A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2 |
下列说法或表示方法正确的是( )
| A.已知C(s)+O2(g)=CO2(g) ΔH1,C(s)+1/2O2(g)="CO(g)" ΔH2;则ΔH1>ΔH2 |
| B.等量的H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| D.由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH >0 |
单斜硫和正交硫是硫的两种同素异形体。已知
①S(s,单斜)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol
②S(s,正交)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol
下列说法正确的是( )
| A.正交硫比单斜硫稳定 |
| B.S(s,单斜)=S(s,正交)ΔH3=+0.33 kJ/mol |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ |
下列热化学方程式正确的是( 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
已知C2H2(g)+ 5/2 O2(g)=2CO2(g) + H2O(l) △H=-1300kJ·mol-1,则下列说法正确的是( )
| A.当有20NA个电子转移时,放出2600kJ 热量 |
| B.当有4NA个碳氧共用电子对生成时,放出1300kJ热量 |
| C.若生成NA个水蒸气分子焓变为△H0,则△H0<△H |
| D.上述反应为吸热反应 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )
| A.C(s、石墨)=C(s、金刚石) △H="+1.9" kJ•mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
在下列各说法中,正确的是
| A.ΔH >0表示放热反应,ΔH <0表示吸热反应 |
| B.1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| C.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═ CO2(g)+2H2O(g)△H = -890.3kJ/mol |
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H =-38.6kJ/mol 2NH3(g)△H =-38.6kJ/mol |
| C.在l01lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H =-571.6kJ/mol |
| D.HCI和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2:反应的中和热△H = 2×(-57.3)kJ/mol |
下列说法正确的是
| A.蓄电池充电时其负极应与外电源的的正极相连接 |
| B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同 |
C.已知:H2(g)+I2(g)  2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 |
| D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1 |
单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜)+O2(g)=SO2 (g) △H1=-297.16kJ·mol-1
②S(s,正交)+O2(g)=SO2 (g) △H2=-296.83kJ·mol -1
下列说法正确的是
| A.S(s,单斜)=S(s,正交)△H3=+0.33kJ·mol -1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多297.16kJ |
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q1 kJ/mol
H2(g)+Br2(g)=2HBr(g) ΔH=-Q2 kJ/mol
有关上述反应的叙述正确的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.生成1molHCl气体时放出Q1热量 |
| D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |