[江西]2013-2014学年江西省南昌市高二上学期期中测试理科化学试卷(乙)
下列关于能源和作为能源的物质叙述错误的是
| A.化石能源物质内部蕴涵着大量的能量 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用 |
| D.吸热反应没有利用价值 |
在下列各说法中,正确的是
| A.ΔH >0表示放热反应,ΔH <0表示吸热反应 |
| B.1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| C.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
已知:25℃、l0lkPa条件下
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9kJ/mol
4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.91kJ/mol: 由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成a mo1A,同时生成3a molB;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间内消耗a molA,同时生成3a molB;
(7)A、B、C的分子数目比为1:3:2。
A.(2)(4)(5)B.(2)(7)C.(1)(3)(4)D.(5)(6)(7)
下列热化学方程式中ΔH表示可燃物燃烧热的是
| A.C(s)+1/2O2(g)="CO(g)" ΔH=-110.5kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=-571.6kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol |
| D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)ΔH=-2800kJ/mol |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
根据以下三个热化学方程式:
(1)2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH= -Q1kJ·mol-1
(2)2H2S(g)+O2(g)=2S(g)+2H2O(g) ΔH= -Q2kJ·mol-1
(3)2H2S(g)+O2(g)=2S(g)+2H2O(l) ΔH= -Q3kJ·mol-1
判断 三者关系正确的是
三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
图为某化学反应速率一时间图。在 时刻升高温度或增大压强,都符合下图所示变化的反应是
时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g) ;ΔH>0 CO(g)+H2(g) ;ΔH>0 |
某反应2A(g) A(g)+2B(g),已知ΔH<0,下列判断正确的是
A(g)+2B(g),已知ΔH<0,下列判断正确的是
| A.仅常温下反应可以自发进行 | B.仅高温下反应可以自发进行 |
| C.任何温度下反应均可以自发进行 | D.任何温度下反应均难以自发进行 |
一定量混合物在密闭容器中发生反应:mA(g)+nB(g) pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
| A.m+n<p | B.平衡向逆反应方向移动 | C.A的转化率降低 | D.C的体积分数增大 |
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
①用物质A表示的反应平均速率为0.3mol∕(L·s)②用物质B表示的反应的平均速率为0. 6 mol∕(L·s)③2s时物质A的转化率为70% ④2s时物质B的浓度为0. 7mol-L-l其中正确的是
| A.③④ | B.②③ | C.①④ | D.①③ |
在密闭容器中进行下列反应M(g)+N(g) R(g)+2L:反应符合如图所示的图象.下列叙述正确的是
R(g)+2L:反应符合如图所示的图象.下列叙述正确的是
| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
C+CO2 2CO; △H1>0,反应速率ν1 N2+3H2
2CO; △H1>0,反应速率ν1 N2+3H2 2NH3; △H2<0,反应速率ν2。如升温,
2NH3; △H2<0,反应速率ν2。如升温, 和
和 的变化是
的变化是
A.同时增大 B.同时减少 C,ν1增大,ν2减少 D.ν1减少,ν2增大
下列事实不能用勒夏特列原理解释的是
| A.由H2、I2蒸气、HI组成的平衡体系加压(减少容器体积)后颜色变深 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.使用加压可使SO2转化为SO3的转化率提高 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
 N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时减小压强 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
C.点d(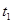 时刻)和点e( 时刻)和点e( 时刻)处n( 时刻)处n( )不一样 )不一样 |
D.其他条件不变,773K下反应至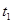 时刻,n(H2)比上图 时刻,n(H2)比上图 |
中d点的值大
(1)CH4(g )+2O2(g )=CO2(g )+2H2O(g ) ΔH=-802.3kJ/mol
该热化学反应方程式的意义是_____________________________________。
(2)已知2g乙醇完全燃烧生成液态水放出Q kJ的热量,写出表示乙醇燃烧热的热化学方
程式:____________________________________________________________.
(3)已知拆开1mol H-H键,1mol N-H键,1mol  键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599kJ/mol ③
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1mol C2H2(g)反应的焓变:
____________________________.
在某密闭容器内有正反应为放热的可逆反应,其中A、B为气体,C为固体,若反应开始经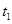 s后达平衡。如图:
s后达平衡。如图:
(1)该反应的化学方程式为_________________________
(2)反应物的转化率______________________
(3)要使反应物的转化率增加可能的原因是____________
A.增大了B或C的浓度 B.使用了催化剂
C.缩小体积,使体系压强增大 D.升高了反应温度
(4)该反应达到平衡后,向该容器中再充入0.5mol的He。若恒温恒压,,这时反应速率 _________(填“加快”、“减慢”或“不变”),平衡_____________ (填“向正方向移动”、“向逆方向移动”、“不移动”);若恒温恒容时,这时反应速率_______(填“加快”、“减慢”或“不变”),反应物的转化率___________(填“加快”、“减慢”或“不变”)。
300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
(1)在2min末时,A的平衡浓度为_____________,B的转化率___________,0-2min内D的平均反应速率为_____________。
(2)该反应的平衡常数表达式为:K=_____________。该温度下的化学平衡常数数值为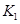 =____________。
=____________。
已知350℃时 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。
(3)在300℃时,将该反应容器压缩体积为lL。则A的转化率___________(填“增大”、“减小”或“不变”),原因是__________________。该条件下的平衡常数为 。 则K3________
。 则K3________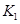 ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判断该反应是否达到化学平衡状态的依据是__________________(多选扣分)。
A.容器中压强不变 B.混合气体中c(A)不变
C. (A)=
(A)= (C) D.混合气体密度不变
(C) D.混合气体密度不变
将等物质的量的A,B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
(l)x的值为_______________;
(2)A的平衡浓度____________;
(3)若恒温恒容,则容器中平衡时的压强与起始时的压强比___________;
(4)下图是某一时间段中该反应速率与反应进程的曲线关系图,回答下列问题:
①处于平衡状态的时间段是____________。
②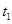 、
、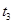 、
、 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?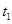 ___________、
___________、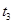 _____________ 、
_____________ 、 _____________(填A-E)
_____________(填A-E)
A.升温 B.降温 C.加催化剂 D.加压 E.减压
③下列各时间段时,A的体积分数最高的是____
A.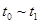 B.
B.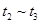 C.
C. D.
D.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号