已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 下列说法正确的是( )
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)= Ba(OH)2(aq)=  BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |
下列各图有关量的变化趋势中错误的是



A B C D
| A.图A为向盐酸中滴加NaOH发生中和反应过程中溶液温度的变化趋势 |
| B.图B为向醋酸中滴加NaOH发生中和反应过程中各物质浓度的变化趋势 |
| C.图C中能量≥Ec的分子称为活化分子,E为分子平均能量,则活化能为Ec-E |
| D.图D为未加入催化剂和加入催化剂的反应进程中的能量变化 |
已知反应 ①
②稀溶液中,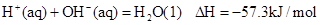 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
下列说法或表示方法正确的是( )
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 |
| B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定 |
| C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol |
| D.2A (l) + B (l) =" 2C" (l) △H1 2A (g) + B (g) =" 2C" (l)△H2 则ΔH1>ΔH2 |
下列说法正确的是( )
| A.反应热就是反应中放出的能量 |
| B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
则下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ/mol |
B.反应①中的能量变化如图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+ O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
已知25℃、10lkPa条件下:
由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H =" -57.3" kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g)△H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g)△H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为 |
2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1
Zn还原SiCl4的反应如下:
SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH1
Si(s) + 2ZnCl2(g) ΔH1
SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH2
Si(s) + 2ZnCl2(g) ΔH2
下列说法正确的是
| A.Zn(l)=Zn(g) ΔH =1/2(ΔH1-ΔH2) |
| B.用硅制作的太阳能电池是将化学能转化为电能 |
| C.增加Zn(g)的量,ΔH2变大 |
| D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热 |
| D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
下列关于反应过程中能量变化的说法正确的是( )
A.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
B.图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH>0未使用和使用催化剂时,反应过程中的能量变化
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |