[湖南]2012-2013学年湖南省怀化市高二上学期期末考试理科化学试卷
下列关于化学变化的叙述错误的是
| A.化学变化一定伴随能量变化 |
| B.化学变化一定有化学键的断裂和生成 |
| C.化学变化一定伴随物质的状态变化 |
| D.化学变化一定有新物质生成 |
中和热测定实验中,通过简易量热计直接测得的数据是
| A.反应的热量变化 | B.体系的温度变化 |
| C.酸或碱的浓度变化 | D.生成水的物质的量 |
下列溶液一定呈酸性的是
| A.pH<7的溶液 | B.c(H+)>c(OH—) 的溶液 |
| C.pH>7的溶液 | D.c(H+)<c(OH—) 的溶液 |
下列变化需要通电才可以进行的是
①电离 ②电解 ③电镀 ④电化学腐蚀
| A.①②③ | B.②③④ | C.②③ | D.全部 |
升高温度,下列数据不一定增大的是
| A.化学反应速率 | B.化学反应的平衡常数 |
| C.水的离子积 | D.吸热反应反应物的转化率 |
下列说法正确的是
| A.放热反应一定能自发进行,吸热反应一定不能自发进行 |
| B.化学反应的反应热不仅与体系的始态和终态有关,也与反应的途径有关 |
| C.催化剂不仅能加快反应速率,也能增大反应物的转化率 |
| D.升高温度,能提高活化分子百分数,不能提高反应所需的活化能 |
下列物质加入水中,对水的电离能产生促进作用的是
| A.NH4Cl | B.NaOH | C.NaCl | D.H2SO4 |
下列关于原电池、电解池的叙述中正确的是
| A.发生氧化反应的电极分别为负极和阴极 |
| B.阴离子分别向负极和阴极迁移 |
| C.电子流向分别由负极直接流向正极、阴极直接流向阳极 |
| D.若都有一个电极质量减轻,应分别为负极和阳极 |
下列有关钢铁的腐蚀和防护的说法中正确的是
| A.钢铁的析氢腐蚀和吸氧腐蚀负极反应相同,正极反应不同 |
| B.镀锌铁皮和镀锡铁皮破损后,前者更易被腐蚀 |
| C.将铁件与电源正极相连,可实现电化学保护 |
| D.将钢管与铜管堆放在一起,可保护钢管少受腐蚀 |
已知在某密闭容器中发生反应 4NH3+5O2=4NO+6H2O,若反应速率分别用
υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则下列关系正确的是
A. υ(NH3) =υ(O2) υ(NH3) =υ(O2) |
B. υ(O2) =υ(H2O) υ(O2) =υ(H2O) |
C. υ(NH3) =υ(H2O) υ(NH3) =υ(H2O) |
D. υ(O2) =υ(NO) υ(O2) =υ(NO) |
一定温度下,可逆反应 A2(g)+3B2(g) 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.容器内A2、B2、AB3的物质的量之比为1:3:2 |
| D.容器内A2、B2、AB3的物质的量浓度相等 |
下列说法中,正确的是
| A.某离子被沉淀完全是指该离子在溶液中的浓度变为0 |
| B.某物质的溶解性为难溶,则该物质的溶解度为0 |
| C.一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物 |
| D.沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动 |
下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
| A.Na2CO3 | B.AlCl3 | C.NaCl | D.NH4Cl |
已知反应 ①
②稀溶液中,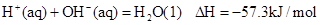 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
下列实验,不能说明乙酸是弱电解质的是
| A.常温时,测得乙酸钠溶液的pH>7 |
| B.常温时,测得0.1 mol·L-1乙酸溶液的pH约为3 |
| C.乙酸溶液与大理石反应产生气泡 |
| D.相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱 |
某密闭容器中发生如下反应 X(g)+3Y(g) 2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
| A.t2时加入了催化剂 |
| B.t3时减小了体系压强 |
| C.t5时升高了体系温度 |
| D.t2、t3、t5变化后反应物转化率均比t1时减小 |
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时覆盖PbO2的电极为正极,发生还原反应 |
| B.放电时电解质溶液中的H+向正极移动 |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.充电时电解质溶液的pH逐渐增大 |
在下列溶液中,各组离子一定能够大量共存的是
| A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ |
| B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.由水电离出的c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| D.与铝作用能产生氢气的溶液:Al3+、K+、SO42-、CO32- |
某碱性溶液中只含有Na+、CH3COO-、H+、OH-,下列说法正确的是
| A.溶液中离子浓度可能满足:c(Na+)>c(OH-) >c(H+)>c(CH3COO-) |
| B.溶液中离子浓度一定满足:c(Na+)= c(CH3COO H)+ c(CH3COO-) |
| C.向溶液中加入适量醋酸,离子浓度可能满足:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D.该溶液可能由pH=11的NaOH溶液和pH=3的醋酸溶液等体积混合而成(常温时醋酸的电离常数为1.75×10-5) |
一定温度下,氯化银在水中存在溶解平衡 AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
| A.③>①>②>④ | B.②>①>④>③ | C.④>③>②>① | D.①>③>④>② |
用惰性电极电解物质的量浓度相等的CuSO4、NaCl混合溶液,电解过程中不可能发生的反应是
A.2Cl-+Cu2+ Cu+Cl2↑ Cu+Cl2↑ |
B.2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
C.2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
(1)已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ;由此说明红磷的稳定性比白磷 。
(2)明矾[KAl(SO4)2·12H2O]水溶液呈 (填“酸”、“碱”或“中”)性;明矾还能净水,用离子方程式解释其原因为 。
(3)电解池的能量转化形式为 ,原电池反应 (填“一定”或“不一定”)自发。
(4)pH=3的盐酸和pH=3的醋酸溶液各稀释至其体积的100倍,稀释后盐酸的pH (填“大于”、“小于”或“等于”)醋酸的pH;常温时pH=x的盐酸和pH=y的NaOH溶液以1︰10的体积比混合,反应后溶液恰好呈中性,则x、y满足的关系是 。
化工中把电解饱和食盐水的工业生产叫氯碱工业,其生产流程如下: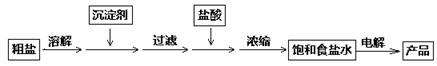
除去食盐水中的Ca2+、Mg2+、SO42—,应分别加入下列沉淀剂:①NaOH(aq)、
②Na2CO3(aq)、③BaCl2(aq),加入沉淀剂的顺序为 (填序号);加入盐酸的作用为 。
(2)下图为实验室电解饱和食盐水的实验装置。X、Y均为石墨电极,两极周围溶液均滴有几滴酚酞试液。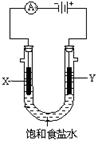
①电解一段时间后,X电极及附近溶液能观察到的现象是 ;
Y电极上的电极反应式为 ,检验该极产生的气体的方法是 。
②电解饱和食盐水的离子方程式为 ;若饱和食盐水体积为200mL,且忽略电解过程中的体积变化及气体溶解,当两极共收集到气体(共两种)44.8mL(标准状况)时,溶液的pH= 。
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.29 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
1.00 |
27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃ |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 投料方式 |
1molCO、2molH2 |
1molCH3OH |
2molCH3OH |
|
| 平衡数据 |
C(CH3OH)/(mol/L) |
c1 |
c2 |
c3 |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
|
| 反应的能量变化 |
akJ |
bkJ |
ckJ |
|
| 原料转化率 |
α1 |
α2 |
α3 |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3 C.|a|+|b|=90.8 D.α1+α3>1
 粤公网安备 44130202000953号
粤公网安备 44130202000953号