下列说法或表示方法中正确的是( )
| A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 |
| B.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| C.相同体积浓度均为0.1 mol/L 盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多 |
| D.氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol |
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是( )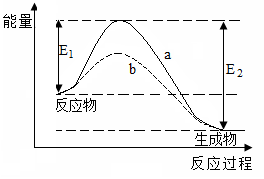
| A.该反应为吸热反应 |
| B.a与b相比,a的反应速率更快 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.反应物吸收的总能量小于生成物释放的总能量 |
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )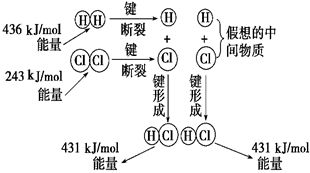
| A.1 mol H2中的化学键断裂时需要吸收436 kJ能量 |
| B.2 mol HCl分子中的化学键形成时要释放862 kJ能量 |
| C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH=+183 kJ/mol |
| D.此反应的热化学方程式为:H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol |
已知:
根据以上热化学方程式判断,下列说法正确的是( )

| A. |
|
| B. |
上图可表示由
|
| C. |
|
| D. |
|
有下列两个反应,当温度降低时,反应a平衡右移,反应b平衡左移。
a、C2H2(g)+H2(g) C2H4(g) b、2CH4(g)
C2H4(g) b、2CH4(g) C2H4(g)+2H2(g)根据上述变化,判断以下几个热化学方程式:
C2H4(g)+2H2(g)根据上述变化,判断以下几个热化学方程式:
C(s)+2H2(g) CH4(g)△H= -Q1 kJ /mol
CH4(g)△H= -Q1 kJ /mol
2C(s)+H2(g) C2H2(g)△H= -Q2 kJ /mol
C2H2(g)△H= -Q2 kJ /mol
2C(s)+2H2(g) C2H4(g)△H= -Q3 kJ /mol
C2H4(g)△H= -Q3 kJ /mol
其中2Q1、Q2、Q3从大到小的顺序是( )
| A.2Q1>Q3>Q2 | B.Q3>2Q1>Q2 | C.Q2>Q3>2Q1 | D.Q3>2Q1>Q2 |
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
| A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1 452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=+1 452 kJ•mol‾1 |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生反应 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)="==" 2H2O(l) △H= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
| A.Q1=Q2<Q3 | B.Q2 > Q1 >Q3 | C.Q3> Q2> Q1 | D.Q1=Q2=Q3 |
下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
| C.△H>0,△S>0,在任何温度下都不可自发进行。 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
下列氧化反应属于吸热反应的是( )
| A.工业上制氨气的反应 | B.葡萄糖在人体内氧化分解 |
| C.锌粒与稀H2SO4反应制取H2 | D.Ba(OH)2·8H2O与NH4Cl反应 |
已知热化学方程式:
(1) H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
(2) H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
| A.吸热88kJ | B.吸热2.44KJ | C.放热44kJ | D.吸热44KJ |
下列关于热化学反应的描述中正确的是
| A.已知H+(aq) + OH-(aq) = H2O(l)DH=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热DH=-114.6kJ·mol-1 |
| B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s)DH=" +95.6" kJ·mol-1 |
| C.常温时H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) DH=+571.6 kJ·mol-1 |
| D.常温时葡萄糖的燃烧热是2800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O( l ) DH=-1400 kJ·mol-1 |
关于中和热测定实验的下列说法不正确的是
| A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B.使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C.向盛装酸的烧杯中加碱时要小心缓慢 |
| D.测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度 |
下列推论正确的是
| A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b |
| B.C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的稀溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行 |
关于下列各图的叙述,正确的是
A.甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量
B.甲表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ
C.乙表示常温 下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同
温同浓度的NaA溶液的pH小于NaB溶液的pH
D.乙图中起始时HA的物质的量浓度大于HB