端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应. 该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线:
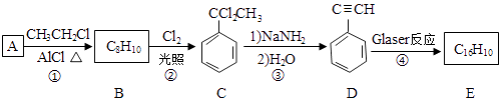
回答下列问题:
(1)B的结构简式为________,D的化学名称为________.
(2)①和③的反应类型分别为________、________.
(3)E的结构简式为________.用 合成1,4﹣二苯基丁烷,理论上需要消耗氢气________mol.
(4)化合物(________)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为________.
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式________.
(6)写出用2﹣苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线________.
(16分)为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
I.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=—574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=—867kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。电解的原理如图所示
则:写出该过程中产生NO的离子方程式:____________。
(3)电解时阴极的电极反应式为____;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。
Ⅲ利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数( )随时间(t)变化曲线如图。
)随时间(t)变化曲线如图。
回答:
(4)T1时,该反应的化学平衡常数的数值为____。
(5)下列说法不正确的是_______(填字母)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,在原容器中充入一定量氦气,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)△H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
CH3COOH(g)△H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
(6)①250—300℃时,乙酸的生成速率减小的主要原因是_______。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是_______。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,它与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -195kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,写出该电池放电时负极的反应式 。
(5)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)="2LiI" (s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4 LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H=_______________;碘电极作为该电池的__________极。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是 ,氧化剂与还原剂的物质的量之比为
(2)从水浸后的滤液中得到K2S04晶体的方法是____。产物K2SO4中K元素的鉴定操作方法是____。
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO2—4恰好沉淀完全的离子反应方程式为 。
(4)焙烧产生的SO2可用于制硫酸。已知25℃、l0lkPa时:
则SO3(g)与H2O(1)反应的热化学方程式是 。
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为 ____
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
在阳极区发生的反应包括 和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2=" -676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式 。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下:
该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为 。
(1)请回答下列问题:
①已知:①CO(g) + 1/2O2(g) = CO2(g) △H= -283.0kJ·mol-1
②CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H= -726.5kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________________________________________________;
②已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应则反应:H2(g)+ Cl2(g)=2HCl (g) 的△H= 。
(2)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①则表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为: 。
②测定中和热实验时所需的玻璃仪器有烧杯、量筒、 、 。
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 。
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低 ④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l)+3 O2 (g)=2CO2(g)+3H2O(l) △H="-1366.8" kJ/mol
②2H2 (g)+O2 (g)=2H2O(l) △H="-571.6" kJ/mol
(1)写出由CO2和H2 反应合成CH3CH2OH (l)和H2O(l)的热化学方程式 。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。通入乙醇燃气的一极为 极,该极上的电极反应式为 。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图:
该装置中发生电解反应的方程式为 ;在铁棒附近观察到的现象是 ;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 。(不考虑气体的溶解及溶液体积的变化)
氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是 。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是 。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。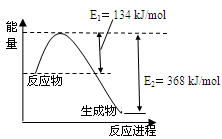
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
下列有关热化学方程式的叙述正确的是 ( )
| A.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为-285.8 kJ/mol |
| B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2 |
下列说法正确的是( )
| A.甲烷的标准燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
| B.已知H2O(L)=H2O(g) ΔH=+44kJ·mol-1,则2g H2(g)完全燃烧生成液态水比生成 气态水多释放22kJ的能量 |
| C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同 |
下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O (l)ΔH= +285.8kJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l)ΔH=" —53.7kJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ |
已知反应:
①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol 下列结论正确的是
| A.碳的燃烧热大于110.5kJ/mol |
| B.①的反应热为221kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
下列说法或表示方法正确的是 ( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(s,石墨)===C(s,金刚石) ΔH=+119 kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ |
| D.在25 ℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1 |