在下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为日常生活中常见的金属单质,其它均为化合物且B为红棕色固体。请回答下列问题:
(1)写出A的原子结构示意图 ▲
(2)写出下列物质的化学式: B: ▲ E: ▲
(3)写出下列反应的化学方程式或离子方程式:
C→F的化学方程式 ▲
G→H的离子方程式 ▲
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝,1molX分解得到A、B、C各1mol。
(1)写出下列各物质的化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;
C→E: 。
(3)写出下列变化的离子方程式:
G→E:
G→F:
(4)写出实验室和工业上制C的化学方程式。
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。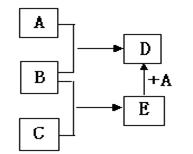
请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为 , A和E反应生成D的化学方程式为 。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为 , A和E在一定条件下反应生成D的化学方程式为 。
A、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:
①A、B、E能使湿润的蓝色石蕊试纸变红,F能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色。
②A和F相遇产生白烟。
③B和E都能使品红溶液褪色。
④将红热的铜丝放入装有B的集气瓶中,瓶内充满棕黄色的烟。
⑤C和D相遇生成红棕色气体,且D可助燃。
⑥G是常见的半导体材料
回答下列问题:
(1)A的化学式是 ,②中的白烟是 (填化学式)。
(2)④中发生反应的化学方程式是
(3)C的化学式是 ,E的化学式是
(4)写出工业上制G的化学方程式
(5)B是一种有毒气体,实验室可用 吸收B,反应的离子方程式是
写出实验室制取B的化学方程式
A、B、C、X均为中学常见的纯净物,它们之间有如图转化关系(副产物已略去)。
回答下列问题:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为________________________或________________________。
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则关于C的以下性质错误的是( )
| A.溶液呈碱性 |
| B.与澄清石灰水反应产生白色沉淀 |
| C.与足量盐酸反应放出气体 |
| D.受热易分解 |
现有金属单质A、B、C和气体甲 、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A 、 B 、 C 、
F 、 H 、乙
(2)写出下列反应离子方程式:
反应①
反应③
反应⑤
反应⑥
某常见金属X,有下列关系图,其中A、B分别是X的正二价、正三价金属离子,请回答:
(1)写出X的名称 ,Y的化学 式 。
式 。
(2)写出下列反应的化学方程式或离子方程式:
① X和稀盐酸反应生成A和某种气体的离子方程式
② +2价的A被Y氧化反应生成+3价的B的离子方程式
③ X粉末和硫酸铜溶液发生置换反应的离子方程式

④ X的正三价氧化物(X2O3)和铝粉反应的化学方程式
(3)A溶液与NaOH溶液在空气中反应的现象  。
。
并写出有关的化学方程式 。
现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
| 阳离子 |
Na+ H+ Ba2+ |
| 阴离子 |
OH- CO32- SO42- |
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X  。
。
(2)B溶于水后的电离方程式为 。鉴别B中阴离子的实验操作方法是
。
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:
B溶液与E溶液反应:
B与C反应至溶液呈中性:
(4)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为 。
根据下面框图填空。已知:物质A的焰色反应呈黄色;物质G是一种白色物质,微溶于水,实验室常用此物质检验二氧化碳气体;D、E为两种气体单质;M是一种合成树脂,常用于制备塑料和合成纤维。
已知碳碳双键与羟基相连的物质很不稳定,自动发生分子内原子重排,有如下变化:
回答:(1)物质C的电子式____________________
(2)写出反应的化学方程式。
反应①_____________ 反应②_________________
反应③_____________ 反应④_________________
A—H代表中学化学中的常见物质,他们之间的转化关系如下(反应条件已略去)
①A+B→C+D+E ②C+F→G+H ③H+D+E→B
(1)若C、D是两种均能使澄清石灰水变浑浊的气体,且D能使品红溶液褪色,F为淡黄色粉末,则反应①的化学方程式是 ,当有 1molF参与反应②时,转移的电子数目为 。反应③中氧化剂与还原剂的物质的量之比为 ,将气体D通人BaCl2溶液中,未见浑浊,如果要使溶液变浑浊,再向溶液中通人的气体可以是
1molF参与反应②时,转移的电子数目为 。反应③中氧化剂与还原剂的物质的量之比为 ,将气体D通人BaCl2溶液中,未见浑浊,如果要使溶液变浑浊,再向溶液中通人的气体可以是  (填2种)。
(填2种)。
(2)若B为黄绿色气体,F为红棕色气体,反应③的部分产物已略去。则反应②的化学方程式是  ,反应③的离子方程式是 ;2molG与lmolB化合生成2mol新物质,该物质的分子中所有原子都达到8电子稳定结构,其电子式为 。
,反应③的离子方程式是 ;2molG与lmolB化合生成2mol新物质,该物质的分子中所有原子都达到8电子稳定结构,其电子式为 。
各物质之间的转换关系如下图,部分生成物省略。
相关信息如下
i.X为红褐色沉淀; ii.A为单质,B为溶液,D和F为气体;
iii.反应②为某化工生产中的尾气处理方式,产物只有Y和H2O。
根据以上信息回答下列问题:
(1)组成A的元素在周期表中属于: (选填序号);
(A)主族元素 (B)副族元素 (C)过渡元素 (D)短周期元素
(2)写出B物质的化学式: ;
(3)写出反应②的化学反应方程式: ;
(4)以石墨为两极材料,电解C的水溶液,写出电解初期阴极的电极反应式: ;
(5)28g单质A与一定浓度的B溶液反应,当生成n(C):n(E):2:3时发生转移 mol电子;
(6)在仅含E的溶液中加入Na2O2生成X时,写出当n(E):n(Na2O2)=1:1时反应的离子方程式: 。
W.X.Y.Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子 序数是Z的原子序数的一半;W.Y.Z位于同一周期。
序数是Z的原子序数的一半;W.Y.Z位于同一周期。
(1)W的单质是一种 色晶体。
(2)W.Y.Z三种元素的气态氢化物稳定性由高到低的顺序是 (用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似)。
(3)用化学方程式证明元素原子的得电子能力Y强于W
(4)Y的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种 稀溶液,并放出QkJ的热量,写出该反应的热化学方程式 。
稀溶液,并放出QkJ的热量,写出该反应的热化学方程式 。
(5)已知A.B.C.D四种物质存在如下反应关系: A+B C+D
C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是 。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是 。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气 造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是 。
造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是 。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所 得消毒液仅含一种溶质,写出相应的化学方程式:___________________________。
得消毒液仅含一种溶质,写出相应的化学方程式:___________________________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
①乙装置中的试剂是 ;
②丁装置中稀硫酸的作用是 ;
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
(6)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知碳酸的酸性强于次氯酸)。