图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应,回答下列问题:
(1)M中存在的化学键类型为_______________________;
(2)一定条件下,Z与H2反应转化为ZH4,ZH4的电子式为_______________;
(3)已知A与1molAl反应转化为X时(所有物质均为固体)的热效应为akJ,则该反应的热化学方程式为_______________;
(4)A与过量D的稀溶液反应生成G的离子方程式为_______________;
(5)向含4molD的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系图乙中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
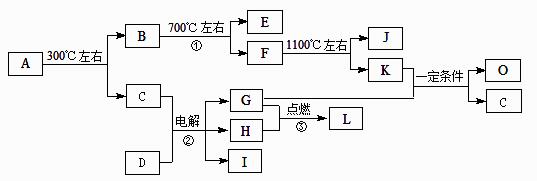
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
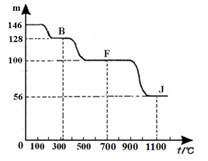
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质.
(1)写出A、B、E、F的化学式:A ________,B________,E________,F________.
(2)写出反应①②③的化学方程式:
①______________________________________;
②______________________________________;
③______________________________________。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_________________________。
甲与B反应的离子方程式 ___________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是___________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式: ____________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明_____________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
(I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2 mol SO2、1 mol O2 |
2 mol SO3 |
m mol SO2、n mol O2、p mol SO3 |
| c(SO3) /mol·L-1 |
1.4 |
1.4 |
1.4 |
| 能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| SO2或SO3的转化率 |
α1 |
α2 |
12.5% |
则:α1+α2=_________________,p=________________mol,b+c="_______________kJ" 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)
较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量) A-+H2C- B.H2B(少量)+2A-
A-+H2C- B.H2B(少量)+2A- B2-+2HA
B2-+2HA
C.H2B(少量)+H2C- HB-+H3C
HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________,最难结合质子的是____________。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________。
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
(1)向酚酞试液中加入化合物A的粉末,现象为_________________________。
(2)单质甲与化合物B反应的离子方程式为________________________5.05g单质甲-钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为________________。
(3)向50mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积 V(HCl)的关系有下列图示两种情况。
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式____________________。 (有几个写几个) 。
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为___________。
③原化合物C溶液的物质的量浓度为____________________。
④由A、B可知,两次实验通入的CO2的体积比为__________。
已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、
H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
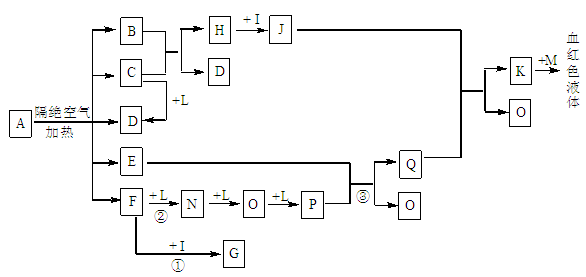
(1)写出D的电子式为_______________;
(2)写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C):
n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为__________________________。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去),已知A由短周期非金属元素组成,B具有漂白性且光照易分解。
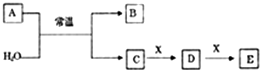
(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______________________;
②A与H2O反应的离子反应方程式为______________________;
③X可能为________(填代号)。a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为______________________;
②A与H2O反应的化学反应方程式为______________________;
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图______________________;
(2)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式______________________;
(3)请写出气体C与氯气发生氧化还原反应的化学方程式______________________。
A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含的同一种元素是___________(写元素符号)。
(2)写出物质C、G的化学式:C___________,G___________。
(3)反应①的反应类型是: (填基本反应类型)。
(4)反应④的离子方程式: 。
(5)检验溶液D中金属阳离子的常用方法是: 。
现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
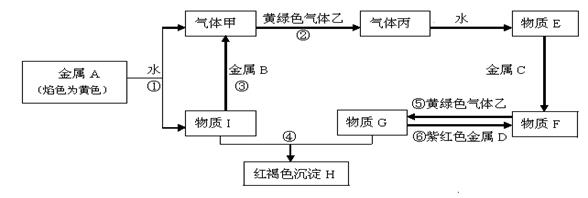
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B ;F ;H ;
(2)写出反应①的离子方程式:
写出反应⑥的离子方程式: ;
(3)气体乙与SO2气体都具有漂白性,将等体积的气体乙和SO2通入到水中,得到的溶液是否具有漂白性?_______________(填“是”或“否”).反应的化学方程式:
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738 kJ·mol-1 I2=1451 kJ·mol-1 I3=7733 kJ·mol-1 I4=10540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:______________________________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有__________个方向,原子轨道呈_______形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背___________________。
该同学所画的电子排布图违背___________________。
(4)G位于________族________区,该元素的核外电子排布式为_________________。
(5)DE3中心原子的杂化方式为____________,用价层电子对互斥理论推测其空间构型为__________。
(6)检验F元素的方法是____________,请用原子结构的知识解释产生此现象的原因:_____________。
A~H是纯净物或溶液中的溶质,其中A是日常生活中应用最广、用量最大的金属单质。它们之间有如下关系:(部分产物和反应条件略)

根据上述信息,回答下列问题:
(1)写出下列物质的化学式B ,E 。
(2)H和 SO2生成强酸F,此反应中氧化剂是 。
(3)写出①的离子方程式: 。
(4)写出②的化学方程式: 。
(5)C溶液中滴入NaOH溶液有何现象 。
所发生反应的化学方程式为___________________,____________________。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______周期_____族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______(填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______g。