[6分]物质A~J均由短周期元素组成,并有如下图转化关系,A是常见液体,D、F为组成元素相同的无色气体,B、E、G、H是单质,且E是常见光太阳电池中的半导体材料,G、H呈气态,且H呈黄绿色。
请回答下列问题:
(1)A的电子式为 。
(2)I的化学式为 。
(3)B与C反应的化学方程式为 。
(4)H与氢氧化钠溶液反应的离子方程式为 。
现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图: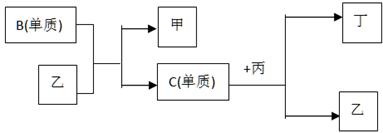
(1)写出B+乙→甲+C的化学反应方程式________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_____。(填写序号)
① A ② B ③ C ④ D
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置 。
B.写出C+丙→乙+丁的化学反应方程式 。
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
淡黄色固体X和气体A存在如下转化关系:
请回答下列问题:
(1)固体X的名称 ;A的化学式 。
(2)写出反应①③的化学方程式,并指出氧化剂。
反应① , 。
反应③ , 。
(3)写出②④反应的离子方程式:
反应② 。
反应④ 。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现红色。
(1)写出下列物质的化学式:
A: D: E: N: 。(每空1分)
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: 。
A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:做无机推断题找到突破点是关键,A是一种高熔点物质,可知A为Al2O3,D是一种红棕色固体,可知D为Fe2O3,B为O2,C为Al,E为Fe,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,H为NaAlO2,I为AlCl3。
(1)电解A物质的阳极电极反应式为___________,C与D在高温下反应,引发该反应需要加入的一种试剂是____________________(写化学式)
(2)写出G→J反应的实验现象与化学方程式____________________________________,__________________________________
(3)H 与I反应的离子方程式为___________________________________________
(4)用离子方程式表示I物质能用于净水的原理___________________________________
Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去),已知A由短周期非金属元素组成,B具有漂白性且光照易分解。
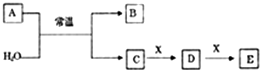
(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______________________;
②A与H2O反应的离子反应方程式为______________________;
③X可能为________(填代号)。a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为______________________;
②A与H2O反应的化学反应方程式为______________________;
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图______________________;
(2)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式______________________;
(3)请写出气体C与氯气发生氧化还原反应的化学方程式______________________。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,D是氧化物,W是淡黄色固体。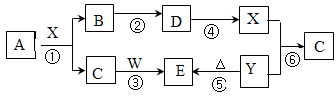
据此回答下列问题:
(1)B、C、D的化学式分别为:B 、C 、D ;从物质分类角度,上图所给物质中属于钠盐的是 (填写化学式)。
(2)上图所给物质在6个反应中只做还原剂的有 (填写化学式)。
(3)上图反应中不属于氧化还原反应的有 (填写序号)。
(4)写出A和X反应的化学方程式 ;若生成的B在标准状况下的体积为22.4L,则参加反应的A的物质的量为 ,反应中转移的电子数目为 。
(5)请写出C和W反应的化学方程式: 。
(6)请写出X和 Y反应的离子方程式: 。
(15分)无机化合物A主要用于药物制造。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C(标准状况)。气体C极易溶于水得到碱性溶液,电解无水B可生成一种短周期元素的金属单质D和氯气。由文献资料知道:工业上物质A可用金属D与液态的C在硝酸铁催化下反应来制备,纯净的A物质为白色固体,但制得的粗品往往是灰色的;物质A的熔点390℃,沸点430℃,密度大于苯或甲苯,遇水反应剧烈,也要避免接触酸、酒精。在空气中A缓慢分解,对其加强热则猛烈分解,在750~800℃分解为化合物E和气体C。
回答下列问题:
(1)A的化学式 。
(2)A与盐酸反应的化学方程式为 。
(3)A在750~800℃分解的方程式为 ,制得的粗品往往是灰色的,其可能的原因是 。
(4)久置的A可能大部分变质而不能使用,需要将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理: 。
(5)工业制备单质D的流程图如下:
①步骤①中操作名称是 。
②试用平衡移动原理解释步骤②中减压的目的是 。
(6)写出D的重氢化合物与水反应的化学方程式为 。
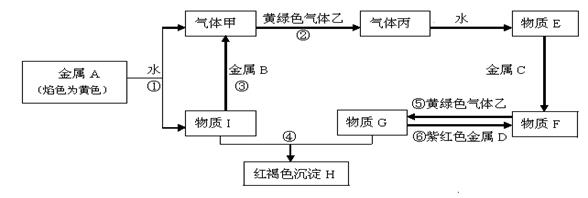
现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B ;F ;H ;
(2)写出反应①的离子方程式:
写出反应⑥的离子方程式: ;
(3)气体乙与SO2气体都具有漂白性,将等体积的气体乙和SO2通入到水中,得到的溶液是否具有漂白性?_______________(填“是”或“否”).反应的化学方程式:
A~H是纯净物或溶液中的溶质,其中A是日常生活中应用最广、用量最大的金属单质。它们之间有如下关系:(部分产物和反应条件略)

根据上述信息,回答下列问题:
(1)写出下列物质的化学式B ,E 。
(2)H和 SO2生成强酸F,此反应中氧化剂是 。
(3)写出①的离子方程式: 。
(4)写出②的化学方程式: 。
(5)C溶液中滴入NaOH溶液有何现象 。
所发生反应的化学方程式为___________________,____________________。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______周期_____族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______(填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______g。
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验Ⅱ中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝____________g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示: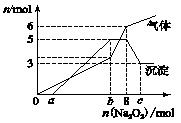
(1)该溶液中一定含有的阳离子是_____________,其对应物质的量浓度之比为____________,溶液中一定不存在的阴离子是____________________。
(2)请写出沉淀减少的离子方程式________________________。