、A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
⑴若 A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式 ;
A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式 ;
②写出反应Ⅰ的化学方程式 。
⑵若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10 电子粒子
电子粒子
①写出A的电子式
②写出反应Ⅱ的化学方程式
⑶若A是地壳中含量最多的金属,B在火焰上灼烧时火焰呈黄色,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀
①写出B的化学式 ②写出反应Ⅲ的离子方程式
⑷若A是黑色粉末,常温 下B是黄绿色气体,C溶液呈碱性,有漂白性。
下B是黄绿色气体,C溶液呈碱性,有漂白性。
写出反应Ⅲ的离子方程式 ;
下图中A、B均为固体,其中B为固体单质。下图可用于工业生产液体F,F的消费量常被视为一个国家工业发展水平的标志。回答下列问题: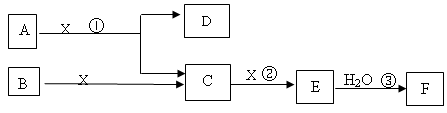
(1)A由两种元素构成,原子个数比为1:2,D为红棕色固体,A的化学式
(2)写出D与铝单质反应的化学方程式
(3)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.这10分钟内,X的平均速率是0. 1mol/( L·min)
B. 在工业生产中可以通过增加X的量来提高C的转化率
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
(4)写出标准状况下2.24L气体C与0.15mol氢氧化钠溶液反应的离子方程式
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 ,试回答:
,试回答:
⑴若X是强氧化性单质,则A不可能是_______________(可多选)。
A. S B. N2 C. Na D. Mg E. Al
⑵若A、B、C为含有同种金属元素的无机化合物,X为强电解质,A溶液与C溶液反应可生成B,则B的化学式可能为________,X的化学式可能为(写出不同类物质)______或__________,反应①的离子方程式为__________或_____________________。
⑶若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则A的电子式为______;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)____________,检验此C溶液中金属元素价态的操作方法是___________________。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
(1)写出下列物质的化学式:
A: D: R: 。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式: ;
向N中通足量CO2时反应的离子方程式: ;
D与盐酸反应的离子方程式: 。
(3)简述检验气体C的方法: 。
下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题:
(1)A的电子式 。
(2)反应①的化学方程式为 ,反应②的离子方程式为 ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L。
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素。(反应中生成的水和部分反应条件未列出)
(1)画出A中阴离子的结构示意图 。
(2)反应②在点燃条件下的现象是 。
(3)H转化为F的氢氧化物最好选择的试剂是 。
(4)反应③的离子方程式为 。
(5)反应④的离子方程式为 。
物质A~E均含同种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应。已知A是一种淡黄色的固体,B是银白色金属单质。

(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:__________________,氧化剂是______,还原剂是______;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式。
| |
现象 |
单质B的相关性质(填序号) |
相关的化学方程式 |
| I |
单质B浮在水面上 |
|
|
| II |
熔成一个小球 |
|
|
| III |
四处游动,发出嘶嘶的声音 |
|
|
| IV |
滴入酚酞试剂,溶液变红 |
|
与反应现象相应的性质:①反应后生成了酸性物质;②反应后生成了碱性物质;③单质B的熔点低;④单质B的密度比水的小;⑤生成了气体;⑥单质B的密度比水的密度大;
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:
________(填序号)
①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大
在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为_________________;D可能为__________________。
(2)若G为蓝色沉淀,H为难溶性盐,则I为_________________。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为______________;F可能为_____________。
(8 分)A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):

(1)若A 是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环中的一种重要物质.则B的化学式是________,C和D反应生成A的化学方程式是_____________。
(2)若A是无色液体,D是一种黑色固体,则C的化学式是_______,由B生成D的化学方程式为____。
(3)若A是碳酸氢钠,且已知碳酸氢钠受热可分解为碳酸钠、二氧化碳和水,写出过量的气体C与D溶液反应生成A的化学方程式 。
A、B、C、D、E五种化合物,均含有前18号元素中某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
(1)写出化学式:A________,B________,C________,D________.
(2)写出下列反应的离子方程式:
B→D___________________,C→E_______________________
(10分)如图中A~H均为中学化学中常见的物质,A、B、H是气体,其中A为黄绿色气体,它们之间有如下转化关系.(反应中生成的水已略去)
请回答以下问题:
(1)E是 ,F是 ,H是 ;(填化学式)
(2)C物质在日常生活中可作 剂。
(3)写出反应①的化学方程式: 。
已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。
钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白:
(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);
②

则 ____________
____________
反应:

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为 ,其中A的化学式是 。
(2)若B是一种能使湿润的红色石蕊试纸变蓝的气体,C是一种溶于强碱而不溶于B的水溶液的白色沉淀,图中B与E反应生成D。则气体B分子的空间构型为___ ,反应①的离子方程式为 。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应②的化学方程式是 。
(4)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。则化合物B的电子式为 ,用电子式表示物质A的形成过程 ,F的饱和溶液与足量E反应的离子方程式为 。