某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是_____________
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是________________。
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_______________________。
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置_________。
(2)写出反应①、⑤、⑥的化学方程式和反应④的离子方程式。
反应①:________________。
反应⑤:________________。
反应⑥:________________。
反应④:________________。
(3)从能量变化的角度看,①、②、③反应中,ΔH<0的是_______(填序号)。
已知下列各物质都是由短周期元素组成,它们之间的关系如下图所示:

常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应均为黄色。请回答:
(1)P的结构式为 ,B的电子式为 。
(2)R的水溶液呈碱性的原因可用离子方程式表示为 。
(3)还有一种物质能与B反应生成C,写出这个反应的化学方程式 。
(4)还有一种单质能与J反应生成C,写出这个反应的化学方程式 。
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出该过程中发生反应的离子方程式______________。
(14分,每空2分)下列关系图中,A是一种正盐,E是强酸,当甲无论是强酸或强碱都有如下反应关系:

友情提示:当甲无论是强酸或强碱,A、B、C、D、E均为同种元素对应的不同的化合物。
回答下列问题:
(1)A是 (用化学式表示)
(2)当甲是稀盐酸溶液时,B为具有臭鸡蛋气味的气体
①写出B与C的反应方程式:
②一定质量的Zn与100mL 12.0mol/L的E的浓溶液充分反应,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)= mol/L,产生SO2体积(标准状况下)= L。
(3)当甲是浓氢氧化钠溶液时,B为易液化的气体可作制冷剂
①C是 ,在浓的E溶液中放入过量的铜片,则反应将要结束时的离子方程式为 。
②将盛有D和O2的混合气体12mL的量筒倒立于水槽中,充分反应后,剩余2mL无色气体(均在同温同压下测定),则原混合气体中氧气的体积是 。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;E原子外围电子排布式为 _______
(2)A与B生成D的反应在工业上是生产 的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为 .
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式
在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出B电解生成E和D的反应方程式: 。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式 ,该反应消耗了2 molG,则转移的电子数是 。
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:a.A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。b.反应①②是化工生产中的重要反应。c.化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。d.化合物L具有漂白性,可由Cl2与NaOH溶液反应制得。e.化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)A元素在元素周期表中的位置____________________。
(2)反应③的化学方程式:________________________。
(3)C的结构式:_____ ___;
F的一种用途:_________________________。
(4)L的溶液与化合物E反应的离子方程式:_________ 。
(5)化合物J的化学式: ________________________。
在下图所示的物质转化中,A、C均为常见的金属单质,并且在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见无色液体。L溶液的焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)。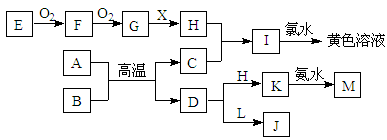
回答以下问题:
(1)H的化学式为 。
(2)L的电子式为 。
(3)A与B反应的化学方程式为 。
(4)K与足量的氨水反应的离子方程式为 。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现红色。
(1)写出下列物质的化学式:
A: D: E: N: 。(每空1分)
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: 。
(共6分)常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________;
(2)化合物甲的电子式是_____________________________;
(3)化合物丙中存在的化学键是__________________________。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素在周期表中的位置是_________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_________________________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。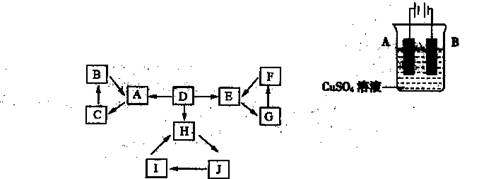
图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
| 编号 |
信 息 |
| 1 |
D为地壳中含量最高的元素组成的单质 |
| 2 |
E为酸性气态氧化物 |
| 3 |
F的浓溶液常做干燥剂 |
| 4 |
H为淡黄色固体化合物 |
| 5 |
电解饱和J溶液是工业重要反应 |
| 6 |
C为离子化合物,阴、阳离子均含有金属元素 |
(1)写出G的化学式: ,指出H中化学键的类型: 。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 。
(3)写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的化学式 。
(4)写出C溶液中通入过量CO2的化学方程式: 。 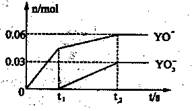
(5)通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是 ,该苛性钾溶液中KOH的质量是 g。
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
| |
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
| |
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
(1)上表中元素⑨对应的二价阳离子未成对电子数目为______________。
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为 。
(3)元素⑦与①⑤形成的化合物的化学键类型有_________ __________;根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因____________。