江西省九江市彭泽县第二高中高一下学期期中考试化学试卷
下列叙述不正确的是
| A.H2S、H2O、HF的稳定性依次增强 |
| B.RbOH、KOH、Mg(OH)2的碱性依次减弱 |
| C.Na+、Mg2+、Al3+的氧化性依次减弱 |
| D.H2SiO3、H2CO3、H2SO4酸性依次增强 |
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-具有相同的电子层结构,则下列说法正确的是
A.原子序数:a>b>c>d
B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.离子还原性:A(n+1)+>Bn+ 离子氧化性:C(n+1)->Dn-
D.单质还原性:B>A 单质氧化性:D>C
氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
| A.Q1 + Q2>Q3 | B.Q1 + Q2<2Q3 | C.Q1 + Q2<Q3 | D.Q1 + Q2>2Q3 |
如图将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是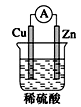
| A.溶液的pH增大 | B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42-浓度增大 | D.溶液的密度增大 |
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如下图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,根据以上信息判断,下列说法正确的是
| A.1 mol N4转变成N2将放出882 kJ热量 |
| B.N4属于一种新型的化合物 |
| C.N4与N2互为同分异构体 |
| D.N4是由极性键组成分子 |
可逆反应3H2+N2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
①消耗3 mol H2的同时生成2 mol NH3
②1个N≡N键断裂的同时,有3个H-H键形成
③H2、N2与NH3的物质的量之比为3∶1∶2
④1个N≡N键断裂的同时,有6个N-H键断裂
⑤1个N≡N键断裂的同时,有6个N-H键形成
| A.①②⑤ | B.②④ | C.①②③④ | D.全部 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是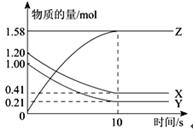
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0 % |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性。以下各组粒子结构不相似的是
| A.CO和N2 | B.O3和NO2— | C.CO2和N2O | D.N2H4和C2H4 |
如下图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等。下列叙述中不正确的是
| A.三种元素的原子半径的大小顺序是W<Y<X |
| B.W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 |
| C.X元素的氧化物、氢化物的水溶液都呈酸性 |
| D.Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
已知磷酸(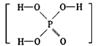 )分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
)分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是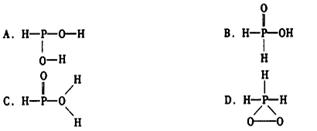
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g) 2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)
②用物质B表示反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
下列化学用语书写正确的是
A.氯原子的结构示意图: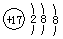 |
| B.作为相对原子质量测定标准的碳核素:614C |
C.氯化镁的电子式: |
D.用电子式表示氯化氢分子的形成过程: |
下列物质中不含非极性共价键的是
①Na2O2 ②CCl4 ③O2 ④NH4Cl ⑤H2O2 ⑥Ca(OH)2
| A.①②③④ | B.④⑤⑥ | C.②③⑤ | D.②④⑥ |
下列变化过程,属于放热反应的是
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④ 固体NaOH溶于水
⑤ H2在Cl2中燃烧
⑥ 碳高温条件下还原CO2
| A.②③④⑤ | B.②⑤ | C.②③④ | D.①③⑤ |
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)
| A.杠杆为导体或绝缘体时,均为A端高B端低 |
| B.杠杆为导体或绝缘体时,均为A端低B端高 |
| C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低 |
| D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高 |
如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是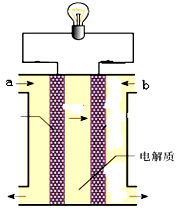
| A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+ |
| B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极上发生的反应为:O2+4e-+2H2O=4OH- |
| C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极上发生的 反应为:CH4-8e-+10 OH-=CO32-+7H2O |
| D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动 |
(共4分)(1)写出下列物质的电子式: HClO 。
(2)用电子式表示下列物质的形成过程:CaCl2 。
(共6分)常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________;
(2)化合物甲的电子式是_____________________________;
(3)化合物丙中存在的化学键是__________________________。
(共11分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0[ |
①请完成此实验设计,其中:V1==__________,V6==__________,V9==________。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
(共9分)现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1)元素B在周期表中的位置 。
(2) A2C比A2E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、 、 。
(4)A2C的电子式为 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为 。
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式 。
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(共12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g)+3 H2(g) 2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) ="=" 13 mol,n t (NH3)="=" 6 mol,则a ==__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)="=" __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) ==__________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号