在下图所示的物质转化中,A、C均为常见的金属单质,并且在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见无色液体。L溶液的焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)。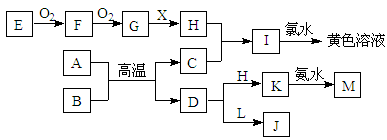
回答以下问题:
(1)H的化学式为 。
(2)L的电子式为 。
(3)A与B反应的化学方程式为 。
(4)K与足量的氨水反应的离子方程式为 。
甲、乙、丙、丁四种物质中,均含有相同的某种元素。在一定条件下它们之间存在如下转化关系:下列说法中错误的是
| A.甲可能是单质,也可能是化合物 | B.丁可能是酸,也可能是碱 |
| C.反应①②一定是氧化还原反应 | D.反应③一定是化合反应 |
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现红色。
(1)写出下列物质的化学式:
A: D: E: N: 。(每空1分)
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: 。
构成A、B、C、D、E五种物质的元素中,只有一种不属于短周期元素。A、B、C、D、E五种物质之间的转化关系如图所示:
下列判断错误的是
A.若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为(NH4)2SO4
B.若A和B都是盐,A难溶于水,而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为NaHSO4
C.若A是2∶1 型的离子化合物,B是硫酸盐,D既可溶于稀盐酸又可溶于NaOH溶液,且A与B的物质的量之比为3∶1时恰好完全反应,则B的化学式为Al2(SO4)3
D.若A是1∶1型的离子化合物,A与过量的B溶液反应才有D生成;将C燃烧的产物通过装有碱石灰的干燥管或盛有浓硫酸的洗气瓶,两者的质量都增加,则B的化学式一定为Al2(SO4)3
(共6分)常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________;
(2)化合物甲的电子式是_____________________________;
(3)化合物丙中存在的化学键是__________________________。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素在周期表中的位置是_________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_________________________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
下图是由常见元素组成的一些单质及其化合物之间的转化关系图。常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑浊;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色。A是一种常见的氮肥,F也能由A直接分解可得到。C、G、K的焰色反应呈黄色。(反应中部分生成物质已略去)
请回答下列问题:
(1)物质D的化学式为 ,其水溶液中阳离子的检验方法(文字表述) 。
(2)写出反应③的化学方程式________________________。
(3)写出反应④的离子方程式________________________。
(4)写出反应⑤的化学方程式,并用双线桥标出电子转移的方向和数目______________________________。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
请问答下列问题:
(1)A是____________,G是______________。(填化学式)
(2)反应①-⑤中,属于氧化还原反应的是________________(填序号)。
(3)反应⑤的化学方程式为_______________________________________________________,
甲与B反应的离子方程式 _____________________________________________________。
在实验室将C溶液滴入F溶液中,观察到的现象是___________________________________。
在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________________________。
已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和 100g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。
上述观点是否正确 ,请通过计算对比数据加以说明____________________________。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。各物质之间的转化关系如图所示(各反应条件略)。
请回答:
(1)在B与二氧化碳的反应中,每有1mol电子转移,生成气体 L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是 。
(3)将C通入溴水中,所发生反应的离子方程式是 。D中含的化学键类型为 。
(4)在101KPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37KJ的热量,该反应的热化学方程式 是
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为 (M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式
已知A为一种盐,隔绝空气加热的条件下发生下述变化,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为常见的单质,I为常见的无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
(1)写出G的电子式____________________,M的化学式_________________。
(2)写出反应②的离子反应方程式_________________________________。
(3)写出反应③的化学反应方程式_______________________,反应①—④中属于非氧化还原反应的是_______________。
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极:___________________________
阳极:__________________________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:1:2,写出A分解的化学反应方程式____________________________。
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_______________________________________________。
(4)F→G的化学方程式___________________________________________。
(16分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)已知化合物C含有下述元素中的某一种元素

①若D是一种强酸,则C与水反应的化学方程式为 。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图装置进行实验.分液漏斗中应加入 ,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是 。

②若D是一种常见的强碱,则C与水反应的离子方程式为 。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题:
(1)若B、C为氧化物且C对应的水化物为强酸。B转化为C时,质量增加25%,则氢化物A转化为B的化学方程式是 。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B生成C的化学方程式是 ,将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是__________。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是__________________________________________;符合条件的D物质可能是________(填序号)。
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。 试回答下列问题:
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式_______________ ;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
(I)阅读下面信息,推断元素,按要求回答问题:
| 信息 |
问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大, 最外层电子数均不少于最内层电子数 |
⑴仅针对信息①,X一定不是 A.氢 B.碳C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH,氧化物的相对式量都大于26 |
⑵这四种元素含有铝元素吗? 。 |
| ③上述四中元素的单质的混合物,加入足量的盐 酸溶液,固体部分溶解,过滤,向滤液中加入过 量的烧碱溶液,最终溶液中有白色沉淀 |
⑶白色沉淀的化学式为 。 |
| ④在W的最价氧化对应的水化合的含氧酸钠盐溶液中,加过量的盐酸能生成白色沉淀。 |
⑷生成白色沉淀的离子方程式为 。 |
| ⑤X与W同主族 |
⑸X的最高价氧化物的电子式为 。 |
(II)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:
已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3 MnSO4+2NH3↑+CO2↑+H2O。
MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。