某化学课外小组利用下图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成。
请回答下列问题:
(1)仪器A的名称是 。
(2)甲装置的c应该与乙装置的 连接(填“d”或“e”)。
(3)乙装置中反应的化学方程式是 。
(4)实验步骤如下:
i仪器组装完毕,检查装置的气密性,加入试剂。打开旋塞a,通入N2一段时间后,关闭旋塞a。
ii打开旋塞b,滴入xmol·L-1浓硝酸V mL,充分反应后冷却,固体仍有剩余。
iii用NaOH溶液滴定乙装置中溶液,得溶质的物质的量为n mol。
①步骤i通入N2的目的是________
②为了准确测定甲装置中产生NO2的量,在步骤ii和iii之间应补充的操作是:
。
③当xV×l0-3 3n(填“>”、“=”或“<”),则证明铜与浓硝酸反应时有NO生成。
④该实验设计中存在一个明显的缺陷是 。
实验室常用饱和NaNO2和NH4Cl溶液反应制取纯净的氮气。反应式为:
NaNO2 + NH4Cl ="=" NaCl + N2↑+2H2O↑,该反应过程中放热。实验如下图,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是:________
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.NaNO2饱和溶液容易滴下
(2)B部分的作用是_________
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行一个操作步骤是: ;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是: 。
(4)收集N2最适宜的方法是________
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
(本小题满分9分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是 。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为__________________;Ⅳ发生反应的化学方程式为 ;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ→Ⅲ→Ⅳ→Ⅱ→Ⅴ→Ⅵ,此时Ⅱ 中现象为 ,原因是 。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________。
实验室常用加热铵盐和碱的固体混合物的方法制取氨气。
根据下图回答问题:
(1)实验室制取氨气的发生装置为 (填序号),该反应的化学方程式为 。
(2)下列气体可以用与氨气相同的收集装置收集的是 (填序号)。
A. H2 B. CO2
(共10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
(1)A中发生反应的化学方程式是 。检验氨气通常采用的方法及现象是_________ ______, 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是 ,该反应中氨的作用是_______剂。
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有_____________,现象是___________________;第二个干燥管Y内装有碱石灰,作用是____________________________。
某化学小组同学利用以下药品及装置制取氨气并研究其性质(部分仪器已略去)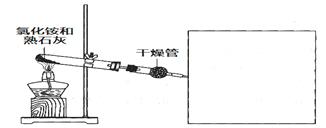
请回答:
(1)制备氨气的化学方程式是________________。
(2)干燥氨气可选用的试剂是________(填选项)。
a. 浓硫酸 b. 碱石灰 c. 氢氧化钠溶液
(3)在方框内绘制用小试管收集氨气的装置图。
(4)在实验室中检验氨气可选用________石蕊试纸。也可用玻璃棒蘸取浓盐酸,若观察到________________(填现象),即可证明,该反应的化学方程式是
________________________________________________________________________
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。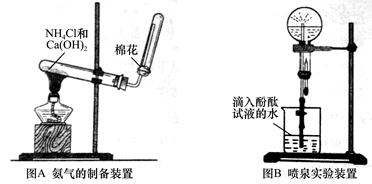
(1)根据图A写出实验室制取氨气的化学方程式_________________________;
如何检验氨气已经收集满 。
(2)甲同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到的实验现象是______________________________________________。根据实验现象说明氨气具有的性质是_____________________________________。
(9分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
(1)铜与稀硝酸反应的化学方程式_____ _ 。
(2)学生甲用装置Ⅰ探究铜与稀硝酸反应的气体产物。实验过程在烧瓶中观察到有红棕色气体产生,在试管中收集到无色气体。 烧瓶中产生红棕色气体的原因是
(用方程式表示)。
(3)学生乙认为,甲用装置Ⅰ实验,无法说明问题。为了证明并观察到铜与稀硝酸反应的产物为NO,甲设计了如图Ⅱ所示的实验装置,选择下列药品,并按下列实验步骤完成该实验。请你根据他的思路,回答下列问题:
药品:稀硝酸锌粒石灰石固体
步骤:
①检查装置的气密性
②向试管中加入一定量CaCO3固体
③向试管中倒入过量的稀HNO3并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将导管插入试管内接近液面
⑤将铜丝插入到溶液中
⑥用注射器的针头穿过橡皮塞并向试管内推入氧气(或空气)
(ⅰ)步骤②目的是 ;
(ⅱ)推入氧气或空气的目的是 ;
(ⅲ)分别将等质量的铜片与等体积均过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出,这可能是Cu2+的浓度差异引起的,你同意这种看法吗?(填“同意”或“不同意”),原因是 。
(本题共12分)
下图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答:
1.硬质玻璃管里发生反应的化学方程式为 。
当三氧化二铬红热时,要移去酒精灯,原因是: 。
2.圆底烧瓶里的实验现象是 ,鼓入空气的作用是 。
3.实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色 。
4.实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式: 。
5.新制的三氧化二铬催化效果较好。实验室一般用加热分解(NH4)2Cr2O7的方法制三氧化二铬,反应的化学方程式为 。
6.工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后 (填一种操作名称)。实验室里保存浓硝酸的方法是 。
亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2 21℃、NO -152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |
(2)如图是甲同学设计收集氨气的几种装置,其中可行的是 ,集气的原理是 。
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质:
(1)写出甲中反应的离子方程式:_________________________________,
乙中的现象是_________________________________________________,
可证明NO2的氧化性;在丙中鼓入空气后的现象是_______________,可证明NO的还原性。
(2)实验前丙中充满水的作用是___________________________________
(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是___________________________________________。
你认为怎样才能准确证明NO2的氧化性?____________________________________(简要回答出原理和现象即可)。
根据下图装置进行实验,已知:Na2O2与H2O和CO2都能反应并生成O2,但与NH3不反应
回答下列问题:。
(1)在受热的试管A中NH4HCO3发生反应的化学方程式为: 。
(2)被加热的铂丝处发生的化学方程式为:___________________________________。
(3)B中出现的现象为:___________________________________________________。
(4)烧杯C中发生的现象为________________________________________________。
(5)倒置漏斗的作用 。
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。