(9分)(1)下图装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
①气体X的分子式是 。
②所选择的药品a是 ,c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)
④请写出在试管a中所发生反应的离子方程式 。
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等体积均过量的浓硝酸或稀硝酸反应(假设反应前后溶液体积不变),所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,这些方案中可行的是 ;
a.加热该绿色溶液,观察颜色变化b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 mL。
(10分)实验室模拟合成氨和氨催化氧化的流程如下:


已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气 。
(2)氮气和氢气通过甲装置,甲装置的作用有干燥气体、 、______________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是:________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 、产生白烟。用化学方程式解释现象产生的原因 。
a mol FeS与b mol FeO投入到V L、c mol·L 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g
③3(a+b) mol ④ mol
mol
| A.②④ | B.②③④ | C.②③ | D.①②③④ |
(11分)三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵( ),其反应化学方程式:2NH3(g)+CO2(g)
),其反应化学方程式:2NH3(g)+CO2(g)  NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取CO2,该实验利用干冰升华产生气体CO2的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素[CO(NH2)2] _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
(18分)Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是 。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为 。
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。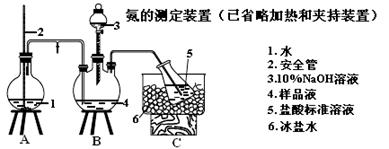
①盛放5(盐酸标准溶液)的仪器名称 。
②装置中安全管的作用原理是 。
③样品中氨的质量分数表达式为 。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。
双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
计算题
(1)某元素的同位素X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,求:元素X的Z值和A值?
(2)在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol/L和0.1 mol/L。向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是多少?
拟用下图装置制取如下表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂)。能达到实验目的的是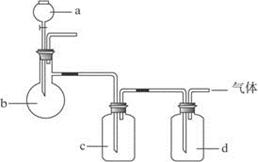
| 选项 |
气体 |
a |
b |
c |
d |
| A |
SO2 |
硫酸 |
亚硫酸钠 |
浓硫酸 |
NaOH溶液 |
| B |
NH3 |
浓氨水 |
消石灰 |
浓硫酸 |
H2O |
| C |
O2 |
双氧水 |
MnO2 |
H2O |
浓硫酸 |
| D |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
某常见二价过渡金属的盐A可发生如图所示的变化,其中B为黑色固体氧化物;C、G为气体氧化物;E为固体单质且不与稀H2SO4反应;D为气体单质;E与F反应时,除生成A外随F的浓度不同产物可以是C也可以是G。
请完成下列问题:
(1)A的化学式 ,D的化学式 。
(2)B转化为E时,有多种方法,请写出其中一个反应的化学方程式 。
(3)C与H2O反应的化学方程式为_ 。
(4)写出E与足量F的浓溶液反应的实验现象: 。
(5)A分解时生成C和D的物质的量之比为 。
已知:Fe2+能被稀硝酸氧化,反应方程式:3Fe(NO3)2+ 4HNO3(稀) ="=" 3 Fe(NO3)3+ NO↑+ 2H2O
现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
| 硝酸体积(mL) |
100 |
200 |
300 |
400 |
| 剩余固体(g) |
18.0 |
9.6 |
0 |
0 |
| 放出气体的体积(mL) |
2240 |
4480 |
6720 |
|
(1)放出4480 mL气体时,消耗金属的质量为_______g
(2)稀硝酸的浓度为_______mol·L-1
(3)计算原混合物中铁和铜的物质的量比为
(4)加入400 mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为 。
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| |
现 象 |
解 释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成棕色NO2能溶于浓硝酸 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
| D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是
| A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL |
| B.当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) |
| C.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol |
| D.参加反应的金属的总质量一定是9.9g |
(15分)某化学课外活动小组通过实验研究NO2的性质:(已知:2NO2+2NaOH = NaNO3+NaNO2+H2O)
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(1)E装置中制取NO2反应的离子方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
①装置的合理连接顺序是(某些装置可以重复使用) 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
取一定质量的均匀固体混合物Cu、CuO和Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20 g,另一份中加入500 mL稀硝酸(其还原产物为NO),固体恰好完全溶解,且同时收集到标准状况下NO气体4.48 L,则所用硝酸的物质的量浓度为
| A.2.4 mol/L | B.1.4 mol/L | C.1.2 mol/L | D.0.7 mol/L |
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。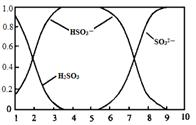
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。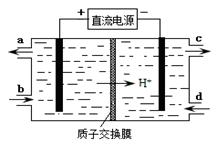
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).