近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列四个方案中,你认为可行而且符合“绿色化学”要求的方案是 ( )
A.Mg Mg(NO3)2 Mg(NO3)2 |
B.Mg MgCl2 MgCl2 Mg(OH)2 Mg(OH)2 Mg(NO3)2 Mg(NO3)2 |
C.Mg MgO MgO Mg(NO3)2 Mg(NO3)2 |
D.Mg MgSO4 MgSO4 Mg(NO3)2 Mg(NO3)2 |
在酸性Fe(NO3)3溶液中逐渐通入H2S气体,可能发生的离子反应是
| A.H2S + 2NO3-+ 2H+ → 2NO2↑+ S↓+ 2H2O |
| B.3 H2S + 2NO3-+ 2H+ → 2NO↑+ 3S↓+ 4H2O |
| C.3Fe3++ 3NO3-+ 6H2S →3NO↑+ 6S↓+ 3Fe2++6H2O |
| D.Fe3++3NO3- + 5H2S+ 2H+ →3NO↑+ 5S↓+ Fe2++6H2O |
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):
(1)反应④的化学方程式为3NO2+H2O====2HNO3+NO,该反应的氧化剂为 ,还原剂为 。
(2)补充并配平反应②的化学方程式:
NH3+ O2 NO+ 。
NO+ 。
(3)化学反应 (填序号)是非氧化还原反应,离子方程式为 。
(4)有人设计了一个反应来制备硝酸:NO2+NH3 HNO3+H2O(未配平),你认为该反应
HNO3+H2O(未配平),你认为该反应
(填“能”或“不能”)发生,理由是 。
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。

已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
已知:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O。为探究如何尽可能多地使NO2被水吸收,某活动小组设计并完成了以下实验。
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
①根据反应原理他们选用了相同的装置 (填“图1”或“图2”)分别制取NO2和O2。
②写出铜与浓硝酸反应的离子方程式 。
③过氧化氢溶液与MnO2制取O2时,MnO2的作用是
_________________________________________________________________。
④收集NO2可采用的方法是 。
(2)活动小组的同学做了如下准备:用气囊收集好纯净的O2;收集了一试管NO2;用干燥的烧瓶收集了一定比例的NO2和O2混合气体。
①为了尽可能多地使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通入O2相比,其优点是
。
②利用图4吸收气体时,其操作和现象为
。
③NO2、O2、H2O反应的产物为硝酸,反应中NO2和O2物质的量之比a∶b= ;标准状况下,若图4中混合气体NO2和O2比例为a∶b,当混合气体全部被吸收时所得溶液物质的量浓度为 mol·L-1(保留两位有效数字)。
氯化亚铜(
)广泛应用于化工、印染、电镀等行业。
难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是
和少量
)为原料,采用硝酸铵氧化分解技术生产
的工艺过程如下: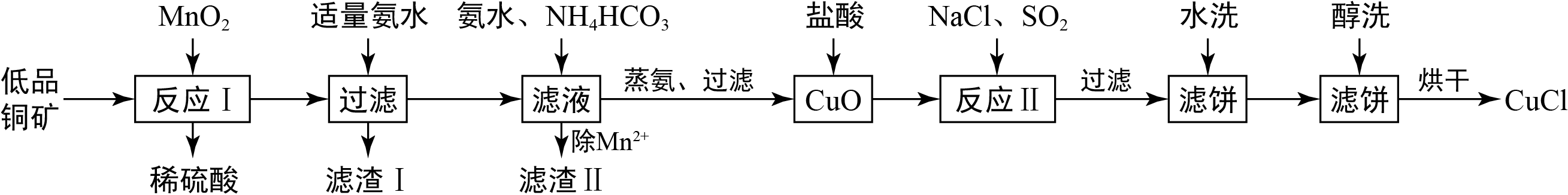
回答下列问题:
(1)步骤①中得到的氧化产物是,溶解温度应控制在60~70度,原因是。
(2)写出步骤③中主要反应的离子方程式。
(3)步骤⑤包括用
=2的酸洗、水洗两步操作,酸洗采用的酸是(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有(填字母)
| A. | 分馏塔 | B. | 离心机 | C. | 反应釜 | D. | 框式压滤机 |
(6)准确称取所制备的氯化亚铜样品 ,将其置于若两的 溶液中,待样品完全溶解后,加入适量稀硫酸,用 的 溶液滴定到终点,消耗 溶液 ,反应中 被还原为 ,样品中 的质量分数为。
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
| A.3 mol/L | B.4 mol/L | C.5 mol/L | D.6 mol/L |
根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________,还原产物是________,氧化剂是________,氧化产物是________。
(2)还原剂与还原产物的物质的量之比是________。
(3)当有8 mol HNO3参加反应时,被氧化的物质的质量为________g,反应中转移的电子的物质的量为________ mol。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。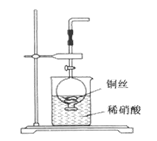
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。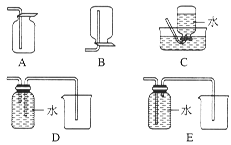
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜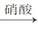 硝酸铜。
硝酸铜。