铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HNO3反应时,主要还原产物为N2O气体;当HNO3更稀时,其主要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 。
(2)a点到b点的还原产物是 ,其原因可能是 。
(3)试完成b点到c点的反应方程式:
□Fe+□HNO3——□Fe( NO3)3+□[ ]+□H2O
(4)反应过程中,到达 点时,HNO3已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是Fe2+,则c点和d点参加反应的铁的物质的量之比是 。
某稀硫酸和稀硝酸的混合溶液 200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解 19.2 g(已知硝酸只被还原为 NO 气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。 下列分析或结果正确的是
| A.每份溶液中 NO—3物质的量为 0.4 mol |
| B.原溶液中 H2SO4浓度为 2.5mol·L-1 |
| C.第一份溶液中最终溶质为 CuSO4和 Cu(NO3)2 |
| D.OA段产生的是NO,AB段的反应为 |
FE+2FE3+=3FE2+,BC段产生氢气
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是
| A.原混合酸中HNO3的物质的量为0.8 mol |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生的是氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4的物质的浓度为2.5 mol·L-1 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
| A.3.6mol/L | B.3.2mol/L | C.2.8mol/L | D.2.4mol/L |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是
| A.只有①或② |
| B.只有②或④ |
| C.只有①或②或③ |
| D.上述四种物质中任意一种 |
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
在注射器A中装有240毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是24000毫升,则X的摩尔质量是________克/摩尔。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________。
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
| A.3 mol/L | B.4 mol/L | C.5 mol/L | D.6 mol/L |
根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原剂是________,还原产物是________,氧化剂是________,氧化产物是________。
(2)还原剂与还原产物的物质的量之比是________。
(3)当有8 mol HNO3参加反应时,被氧化的物质的质量为________g,反应中转移的电子的物质的量为________ mol。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。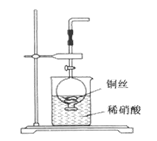
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。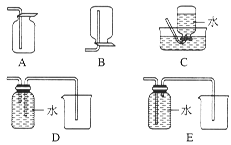
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜 硝酸铜。
硝酸铜。