在钠离子浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子。(已知硅酸为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
| 阳离子 |
K+ |
Ag+ |
Ca2+ |
Ba2+ |
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是 。
(2)实验Ⅰ中生成气体的离子方程式为 。
(3)通过实验Ⅰ、Ⅱ和Ⅲ必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol/L |
|
|
|
|
下列各组离子在指定溶液中一定能大量共存的是
A.Ksp(AB2)小于Ksp(CD),则化合物AB2的溶解度一定小于化合物CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的溶解度增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变红的溶液中:NH4+、Mg2+、SO42-、NO3- |
| B.1.0 mol•L-1FeCl3溶液中:Na+、Cl-、NO3-、SCN- |
| C.1.0 mol•L-1KNO3溶液中:Fe2+、H+、Cl-、SO42- |
| D.与Al反应能放出H2的溶液中:Na+、Cl-、HCO3-、SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Ca2+、Fe2+、NO3-、CO32- |
| B.Kw/c(OH-)="0.1" mol•L-1的溶液中:Na+、NH4+、Cl-、NO3- |
| C.c(Fe3+)="0.1" mol•L-1的溶液中:K+、SCN-、SO42-、Cl- |
| D.由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Na+、AlO2-、HCO3-、OH- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.无色溶液中:K+、Fe3+、SO42-、H+ |
| C.c (H+)/c (OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42- |
| B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3- |
| C.使石蕊试液变红色的溶液中:Fe2+、K+、NO3-、SO42- |
| D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+ 5种离子,现进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有的离子是 ,一定不含的离子是__________,还有一种离子不能确定是否存在,要检验这种离子的实验方法是 。
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中: |
B. 的溶液中: 的溶液中: |
C. 的溶液中: 的溶液中: |
D.由水电离的 的溶液中: 的溶液中: |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤,剩余沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+一定存在,且c(K+)≥0.2mol ·L―1 |
| B.100 mL溶液中含CO32― 0.01mol |
| C.K+不一定存在 |
| D.Cl― 一定存在 |
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、Na+
④含有大量NH4+的溶液中:K+、Ba2+、Cl-、H+
⑤能使甲基橙变红的溶液:Na+、Cl-、SiO32-、K+
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
| A.②⑤ | B.②④⑥ | C.②④ | D.③⑤⑥ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:K+、Na+、Cu2+、SO42- |
| B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl- |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
某种盐可表示为[xFeSO4·y(NH4)2SO4·6H2O](其摩尔质量为392g·mol-1),可用作标定重铬酸钾、高锰酸钾等溶液的标准物质,也可用于冶金、电镀。为测定其组成,进行下列实验:
①取一定质量的上述盐样品,准确配制100mL的溶液X;
②量取20.00mL的溶液X,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,烘干至恒重,得到白色固体Y 4.660g
③另取20.00mL的X溶液,滴加适量硫酸,用0.1000mol·L-1的KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液20.00mL。
(1)在20.00mL试样溶液中c(SO42-)= mol·L-1,n(Fe2+)= mol;
(2)该盐的化学式为 。
在指定环境中,下列各组离子一定可以大量共存的是
A.25℃, 的溶液中:ClO-、Cl-、K+、HSO3- 的溶液中:ClO-、Cl-、K+、HSO3- |
| B.无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4] 2+ |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.加入Al能放出H2的溶液中:NH4+,SO42-,Br-, NO3- |
常温下,某溶液A中可能含有NH4+、K+、Na+、Al3+、Fe2+、Fe3+、CO32—、SO32-、Cl-、SO42—,现取该溶液进行有关实验,实验结果如下图所示:
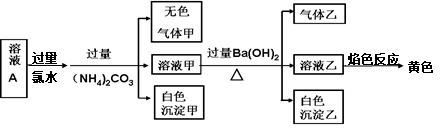
下列有关说法正确的是
| A.溶液中一定有SO42—,可能有K+、Cl- |
| B.溶液中一定不存在的只有Fe2+和CO32—两种离子 |
| C.溶液中一定存在Al3+、Na+ |
| D.生成的甲、乙两种气体均无色,且均易溶于水 |
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |