常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.水电离的c( H+)= 1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- |
| B.能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl- |
C. =lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3- =lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3- |
| D.能与铝反应放出H2的溶液中:Fe2+、K+、SO42-、Cl- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中: |
B. 的溶液中: 的溶液中: |
C. 的溶液中: 的溶液中: |
D.由水电离的 的溶液中: 的溶液中: |
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
| A.①③⑤ | B.② | C.②④⑥ | D.④⑤ |
下列各组离子能在指定溶液中共存的是( )
①无色溶液中: 、
、 、
、 、
、 、
、
②使pH试纸变深蓝的溶液中: 、
、 、
、 、
、 、
、 、
、
③水电离的 的溶液中:
的溶液中: 、
、 、
、 、
、 、
、
④既能溶解Al(OH)3,又能溶解H2SiO3的溶液中: 、
、 、
、 、
、
⑤使甲基橙变红的溶液中: 、
、 、
、 、
、 、
、
⑥pH=0的溶液中: 、
、 、
、 、
、 、
、 、
、
| A.①③ | B.②④⑤ | C.①②⑤ | D.③⑥ |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测不正确的是
| A.K+一定存在 |
B.100mL溶液中含0.01mol CO |
| C.Cl-可能存在 |
| D.Ba2+和Cl-一定不存在 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+,取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知有关原溶液中离子的说法不正确是( )
| A.至少存在4种离子 |
| B.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C.SO42-、NH4+一定存在 |
| D.CO32-、Al3+、K+一定不存在 |
Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________,一定不存在__________。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______(填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________,C__________,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤,剩余沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+一定存在,且c(K+)≥0.2mol ·L―1 |
| B.100 mL溶液中含CO32― 0.01mol |
| C.K+不一定存在 |
| D.Cl― 一定存在 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:K+、Na+、Cu2+、SO42- |
| B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl- |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO- |
某种盐可表示为[xFeSO4·y(NH4)2SO4·6H2O](其摩尔质量为392g·mol-1),可用作标定重铬酸钾、高锰酸钾等溶液的标准物质,也可用于冶金、电镀。为测定其组成,进行下列实验:
①取一定质量的上述盐样品,准确配制100mL的溶液X;
②量取20.00mL的溶液X,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,烘干至恒重,得到白色固体Y 4.660g
③另取20.00mL的X溶液,滴加适量硫酸,用0.1000mol·L-1的KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液20.00mL。
(1)在20.00mL试样溶液中c(SO42-)= mol·L-1,n(Fe2+)= mol;
(2)该盐的化学式为 。
常温下,某溶液A中可能含有NH4+、K+、Na+、Al3+、Fe2+、Fe3+、CO32—、SO32-、Cl-、SO42—,现取该溶液进行有关实验,实验结果如下图所示:
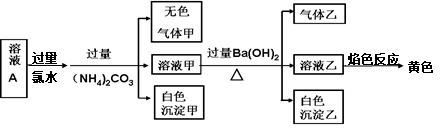
下列有关说法正确的是
| A.溶液中一定有SO42—,可能有K+、Cl- |
| B.溶液中一定不存在的只有Fe2+和CO32—两种离子 |
| C.溶液中一定存在Al3+、Na+ |
| D.生成的甲、乙两种气体均无色,且均易溶于水 |
下列各组离子一定能大量共存的是
| A.在含有大量AlO2-的溶液中:NH4+、 Na+、Cl-、H+ |
| B.在强碱溶液中:Na+、K+、CO32-、NO3- |
| C.常温下,在pH=12的溶液中:Mg2+、Na+、SO42-、Cl- |
| D.在水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、I-、Cl-、NO3- |
在下列条件下,一定能大量共存的微粒组是:
| A.甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- |
| B.能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- |
| C.常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- |
| D.常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
在指定环境中,下列各组离子一定可以大量共存的是
A.25℃, 的溶液中:ClO-、Cl-、K+、HSO3- 的溶液中:ClO-、Cl-、K+、HSO3- |
| B.无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4] 2+ |
| C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D.加入Al能放出H2的溶液中:NH4+,SO42-,Br-, NO3- |
某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12L气体(标准状况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为6.27g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。
根据上述实验回答下列问题:
①溶液中一定不存在的离子是____________;
②溶液中一定存在的阴离子有________,其物质的量浓度分别为__________;
③推断K+是否存在并说理由:_________。