某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
Ⅰ.现有Al3+、NH4+、CO32—、HCO3— 等离子,回答下例问题:
①在强酸性条件下能够存在的离子是 ;
②在强碱性条件下能够存在的离子是 ;
③在强酸性和强碱性条件下都不能存在的离子是 。
Ⅱ.由Na+、NH4+、 Ba2+、 Cu2+、 OH—、 Fe3+、 SO42—、 Cl— 等八种离子中的六种两两组成的A、B、C三种化合物(它们不含有共同离子,已知NH4+与OH— 反应有碱性气体生成)。
A.A、B、C均易溶于水,形成无色溶液;
B.将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:
①A、B、C的化学式为:
A、 ;
B、 ;
C、 。
②B+C反应的离子方程式为: 。
某溶液中可能存在Mg2+、Na+、K+、Al3+、Br-、CO32-、SO32-、Cl-等8种离子中的某几种。现取该溶液进行实验,得到如下现象:
①用铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
②向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
③将②所得溶液分为2份,一份加入足量BaCl2溶液,有白色沉淀生成,另一份加入AgNO3溶液,有白色沉淀生成。
据此可以推断:该溶液肯定存在的离子是______________________________。
Ⅰ.有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示;
试推断:
(1)溶液中一定含有的离子是_________________;
(2)溶液中肯定不含有的离子是_________________;
(3)可能含有的离子是________________;
(4)为了进一步确定可能含有的离子,应增加的实验操作为___________________。
Ⅱ.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图,已知沉淀2为蓝色。
(1)沉淀的化学式:沉淀1____________、沉淀3____________;
(2)写出混合液+A的离子方程式 _________________;
写出溶液+B生成沉淀2的离子方程式_________________;
Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________,一定不存在__________。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______(填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________,C__________,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO42-,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
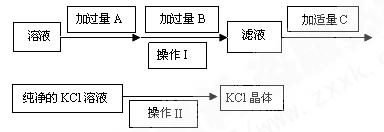
(1)上述试剂中,B是 ,C是 。
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种。为了确定溶液的组成,进行了如下操作:

(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如表所示,回答下列问题:
| Cl2的体积(标况下) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5 mol |
2 mol |
| n(Br-) |
1.5 mol学] |
1.4mol |
0.9 mol |
| n(I-) |
a mol |
0 |
0 |
①则a为
②原溶液中Cl-、Br-、I-的物质的量浓度之比为
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
已知:HCO3-+ AlO2-+H2O="=" Al (OH)3↓+ CO32-
下列说法正确的是
| A.气体乙和气体丙都为纯净物 |
| B.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有Na2CO3、NaHCO3 |
| C.溶液丁中的阳离子一定只含H+、Fe2+ |
| D.溶液甲中一定含有AlO2-,可能含有CO32- |
某混合物的水溶液中,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______________。
(2)用离子方程式表示该溶液呈碱性的原因:____________________________________。
(3)K+是否存在?_____,(填“是”或“否”)若存在,浓度范围是______________________ (若不存在,则不必回答第(2)问)。
(4)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
____________________________________________________________________。