某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
Ⅰ.现有Al3+、NH4+、CO32—、HCO3— 等离子,回答下例问题:
①在强酸性条件下能够存在的离子是 ;
②在强碱性条件下能够存在的离子是 ;
③在强酸性和强碱性条件下都不能存在的离子是 。
Ⅱ.由Na+、NH4+、 Ba2+、 Cu2+、 OH—、 Fe3+、 SO42—、 Cl— 等八种离子中的六种两两组成的A、B、C三种化合物(它们不含有共同离子,已知NH4+与OH— 反应有碱性气体生成)。
A.A、B、C均易溶于水,形成无色溶液;
B.将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:
①A、B、C的化学式为:
A、 ;
B、 ;
C、 。
②B+C反应的离子方程式为: 。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Al3+、Cu2+ |
| 阴离子 |
OH-、HCO3-、NO3-、SO42- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象。
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:B ;C 。
(2)写出过量E滴人到C溶液中的离子反应方程式 。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(4)在A溶液中加澄清石灰水,其离子方程式为 。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42﹣、和NO3﹣的分离.实验过程如下图所示:
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X:_______,沉淀A:_______。
(2)上述实验流程中加入过量的Na2CO3的目的是_______。
(3)按此实验方案得到的溶液3中肯定含有_______(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_______,之后若要获得固体NaNO3需进行的实验操作是_______(填操作名称)。
一种固体物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成。为检验它们,做了以下实验。
(1)将固体物溶于水,搅拌后得到无色透明溶液;
(2)取此溶液适量,向其中滴加过量的硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
试判断:
固体物中肯定有________,肯定没有____________________,可能有________,对可能有的物质,可采用向滤液中滴加________溶液的方法来检验。
某溶液中可能存在Mg2+、Na+、K+、Al3+、Br-、CO32-、SO32-、Cl-等8种离子中的某几种。现取该溶液进行实验,得到如下现象:
①用铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
②向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
③将②所得溶液分为2份,一份加入足量BaCl2溶液,有白色沉淀生成,另一份加入AgNO3溶液,有白色沉淀生成。
据此可以推断:该溶液肯定存在的离子是______________________________。
有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、NaHSO4、BaCl2中的一种,为了确定各是何种溶液进行了下列实验,记录为::①A+D→溶液+气体,②B+C→溶液+沉淀,
③B+A→溶液+沉淀X,④D+B→溶液Y+沉淀,⑤溶液Y+沉淀X→溶液+气体.
(1)根据以上记录确定:A__________ B___________ C___________ D___________
(2)写出①、③各反应的离子方程式:
①_______________③______________
有甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阴、阳离子各一种组成,已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)它们的化学式分别为甲_________、乙_________、丁_________。
(2)写出甲溶液和丁溶液反应的离子方程式:_________________________。
(3)检验乙中阴离子所用试剂的名称是____________________。
实验室中有四种化合物A、B、C、D,分别可能由以下两组离子中的各一种所构成:(离子可以重复使用)
阳离子组:Na+、Mg2+、Cu2+、Ba2+
阴离子组:OH-、Cl-、SO42-、CO32-
(1)A不溶于水,也不溶于酸
(2)B溶于水后,若与阳离子组中的另一种离子反应,有A生成;若与阴离子组中的另两种离子反应,均产生白色浑浊现象
(3)C溶于水后,与阳离子组中的任一种离子都不反应;将一根铁棒置于C溶液中,一段时间后铁棒增重
(4)D的水溶液显碱性,与阴离子组中的另两种离子反应,分别生成A和一种白色沉淀
回答下列问题:
(1) 写出下列物质的化学式: B________, C________, D________,
(2) 检验A中阴离子的方法为_____________________________。
(3) 写出B与D反应的离子方程式:________________________。
(4) 将铁棒置于C溶液中一段时间后,铁棒增重0.8g,计算有_____mol Fe参与反应。(要求书写计算步骤)
Ⅰ.有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示;
试推断:
(1)溶液中一定含有的离子是_________________;
(2)溶液中肯定不含有的离子是_________________;
(3)可能含有的离子是________________;
(4)为了进一步确定可能含有的离子,应增加的实验操作为___________________。
Ⅱ.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图,已知沉淀2为蓝色。
(1)沉淀的化学式:沉淀1____________、沉淀3____________;
(2)写出混合液+A的离子方程式 _________________;
写出溶液+B生成沉淀2的离子方程式_________________;
Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________,一定不存在__________。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______(填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________,C__________,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(请写出最佳答案):
(1)所加试剂的化学式:A_________、B__________、C__________
(2)写出生成沉淀1的离子方程式_________________________;生成沉淀3的离子方程式_____________________________;
(3)试猜想上述溶液中一定存在的另一种离子是________(写化学式),请写出该离子所对应的一种盐的电离方程式__________________。
现有失去标签的四瓶无色溶液分别为Na2CO3溶液、稀盐酸、Ba(OH)2溶液、NaHSO4溶液,为确定四瓶溶液分别是什么,将其随意标号为A、B、C、D,分别取少量溶液两两混合,产生的现象如下表所示。
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A + B |
生成白色沉淀 |
| ② |
A + C |
放出无色气体 |
| ③ |
A + D |
放出无色气体 |
| ④ |
B + C |
无明显变化 |
| ⑤ |
B + D |
生成白色沉淀 |
| ⑥ |
C + D |
无明显变化 |
已知:NaHSO4属于酸式盐,在水溶液中的电离方程式为:NaHSO4 = Na+ + H+ + SO42- 。
根据实验现象,回答下列问题:
(1)A为 ,C为 。
(2)写出下列反应的离子方程式
A + B ,A + D ,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为 ,反应后得到的溶液中含有的阴离子有 。
(4)上述没有明显变化的实验④、⑥,其中 发生了离子反应,离子方程式为 。请设计实验证明其发生了反应 。(试剂任选)
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO42-,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
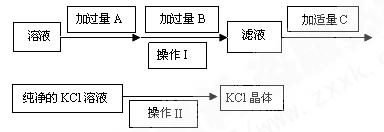
(1)上述试剂中,B是 ,C是 。
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种。为了确定溶液的组成,进行了如下操作:

(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如表所示,回答下列问题:
| Cl2的体积(标况下) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5 mol |
2 mol |
| n(Br-) |
1.5 mol学] |
1.4mol |
0.9 mol |
| n(I-) |
a mol |
0 |
0 |
①则a为
②原溶液中Cl-、Br-、I-的物质的量浓度之比为
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
已知:HCO3-+ AlO2-+H2O="=" Al (OH)3↓+ CO32-
下列说法正确的是
| A.气体乙和气体丙都为纯净物 |
| B.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有Na2CO3、NaHCO3 |
| C.溶液丁中的阳离子一定只含H+、Fe2+ |
| D.溶液甲中一定含有AlO2-,可能含有CO32- |