某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
①该溶液中一定存在的离子有______________,一定不存在的离子_____________。
②用一个离子方程式表示操作②的实验现象:__________________________。
某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝。两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为_____________、____________。向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失则该溶液为_____________溶液;另一种溶液中的现象是______(填序号)。
①产生白色沉淀
②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
(7分)某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①是_________;操作②是_________;操作⑤是_________。(填操作名称)
(2)操作②需要的主要玻璃仪器除烧杯外,还需要_________。
(3)加入足量的X、Y、Z是为了除去溶液中的杂质,它们依次是BaCl2溶液 、KOH溶液和 ____溶液。
(4)检验无色溶液B中是否含有SO42-的方法是_________。
某无色待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等阳离子。某同学进行如下实验:
I.加入过量的稀盐酸,有白色沉淀生成。
II.过滤,取少许滤液,向其中加入过量的稀硫酸,又有白色沉淀生成。
III.另取少量步骤II中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
(1)待测液中一定含有的离子是 ,一定不含有的离子是 。
(2)步骤III中产生气体的离子方程式为 。
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 |
Cl- CO32- NO3- SO42- SiO32- I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为 。
无色透明溶液中可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取原溶液少许,加铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取原溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取原溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
(1)根据上述实验判断原溶液中上述离子肯定存在的是 ,
肯定不存在的是 。
(2)写出与②③两个实验有关的离子方程式:
② ,
③ 。
(12分)某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: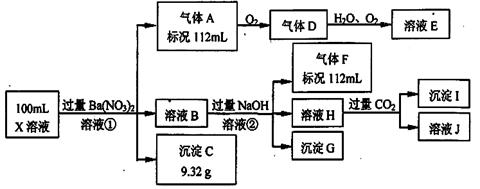
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
(2)用离子方程表达下列反应:
①中生成气体A:___________ __。
②中生成溶液H:____________ _。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
某强酸性溶液X中可能含有H+、A13+、NH4+、Fe2+、CO32-、SO42-、C1-、NO3- 中的若干种。某研究性小组为了探究其成分,进行了如下实验:
请回答下列问题:
(1)沉淀C的化学式为 ,气体A的化学式为 。
(2)写出向溶液H中通入过量CO2气体生成沉淀I的离子方程式: 。
(3)通常可以利用KClO在KOH溶液中氧化沉淀G来制备一种新型、高效、多功能水处理剂K2MO4。(M为G中的一种元素,K2MO4易溶于水)请写出制备过程中的离子方程式(M用具体的元素符号表示) 。
(4)无法确定的离子是 ,请设计实验验证该离子是否存在的方法 。
(8分)某工业废水中,除H+、OH-外仅含下表离子中的几种。
甲同学欲探究废水的组成,进行了如下实验:
I.取少量废水样品,加入KSCN溶液无明显变化。
II.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解。
请回答下列问题:
(1)废水中一定含有的金属阳离子是___________(填离子符号)。
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是____________________________。
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的________(填离子符号),其判断理由是_________________________________________。
(12分)某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-、NO3-,已知该溶液能与铝反应且放出的气体只有氢气。试回答下列问题:
(1)若反应后生成Al3+,反应的离子方程式为________________,则原溶液中一定大量存在的离子有________________,一定不能大量存在的离子有__________________。
(2)若反应后生成AlO2-,反应的离子方程式为 ,则溶液中一定大量存在的离子有 ,一定不能大量存在的离子有 。
某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有 离子,一定不含有 离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是 观察到的现象是 。
已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步: 第三步: ;
(2)待测液中一定含有 、NO3-离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) , 。
(3分)在含有Al3+、Ba2+、Fe3+三种离子的混合溶液中只加一种试剂达到下列目的。所给的备选试剂有:氨水、NaOH溶液、H2SO4溶液、AgNO3溶液、Na2CO3溶液
(1)只让Ba2+离子沉淀完全,应加入________________;
(2)要让Al3+、Fe3+两种离子沉淀完全,应加入_________________;
(3)使三种离子全部转化为沉淀,应加入__________________________。
(12分)国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是________(选填序号).
| A.SO42- | B.NO3- | C.Cl- | D.CO32- |
(2)检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是________,铝元素发生变化的离子方程式是______________________.
(3)为了回收废液中的金属银,某同学设计了如下方案:
若依该方案获得银108 g,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气________L.