某溶液中可能含有Cl-、SO42-、NO3-、CO32-等阴离子。
(1)、当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是 。原因是(用离子方程式表示) 。
(2)、当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是 。
A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
②分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A B C D
(2)写出实验步骤②中A盐产生白色沉淀的离子方程式:
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
已知某溶液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-、Cl-、SO42-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
(1)由现象推断,溶液中一定含有 离子,一定没有 离子,可能有 离子。
(2)写出第三步涉及的所有离子方程式 。
按要求完成下列内容。
(1)写出下列物质的电离方程式
盐酸
氢氧化钠溶液
氯化钡溶液
碳酸氢钠溶液
(2)写出下列反应的离子方程式
①锌和稀硫酸溶液的反应:
②碳酸钙与稀盐酸的反应:
③氯化铜溶液与氢氧化钠溶液的反应:
(3)写出符合离子方程式Ag++Cl-=AgCl↓的一种化学方程式 。
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示:
| 检测次数 |
溶液中检测出的物质 |
| 第1次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第2次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第3次 |
Na2SO4、KCl、K2CO3、NaCl |
查阅资料:Ag2SO4、CaSO4微溶于水
(1)三次检测中,检测结果肯定不正确的是 。
(2)SO42-、CO32-和Cl-的检测最佳顺序是 。
(3)在上述检测中,若只取一次某溶液:
①检测SO42-时,所用试剂是 。
②检测CO32-时,所加试剂必须过量的原因是 。
③检测Cl-时,请写出其中的一个有关反应化学方程式是 。
对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有SO42-、Na+、CO32- 、H+、NO3-、NH4+、Cl-等离子中的若干种。然后又做了如下实验,以确认这些离子是否大量存在。
①用pH试纸测溶液的pH,试纸显红色;
②取2毫升溶液,用氯化钡和稀硝酸进行检验,结果生成了白色沉淀;
③对②中所得混合物充分静置后,取上层清夜用硝酸银溶液和稀硝酸检验,结果又生成了白色沉淀;
④另取2毫升溶液,加入足量氢氧化钠溶液并加热,没有产生能使湿润红色石蕊试纸变蓝的气体。
试回答下述问题:
(1)原溶液中一定存在的离子是
(2)原溶液中一定不存在的离子是
(3)按上述操作,原溶液中还不能肯定是否存在的阳离子是
检验该阳离子方法是
(10分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是_________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加__________溶液的方法来检验。
(2)写出步骤③中的离子方程式______________________________________。
附加题某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下所示(写出最佳答案)
(1)沉淀的化学式:沉淀1 ,沉淀2 ,沉淀3 ;
(2)写出混合液+A的离子方程式: 。溶液+B的离子方程式: 。
某蓝色电解质溶液中,只可能大量存在有Ag+、H+、Cu2+、CO32—、OH—、Cl—中的某些离子,你认为一定有的离子是 ,一定没有的离是 ,还需进一步确认的是 。
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加 溶液(填化学式),其目的是 。
第二,继续加入过量的该溶液,其目的是 。
第三,再向溶液中加入 溶液(填化学式),确定 离子的存在,其离子反应方程式为 。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g。 |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
| |
|
| |
|
(3)试确定K+是否存在?________,判断的理由是______________________________
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图(沉淀2为蓝色)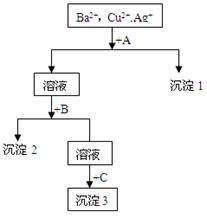
(1)沉淀的化学式:沉淀1 ,沉淀3 ;
(2)写出混合液+A的离子方程式:
溶液+B的离子方程式:
有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;②往此溶液中滴加氯化钡溶液,有白色沉淀生成;③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有 ,一定没有 ,可能含有________________。
(2)对可能含有的物质,如何进行实验以进一步检验。
(3)实验④中发生的化学反应属于 反应(填反应类型),主要实验操作名称叫