常温下,下列各组微粒在指定溶液中一定能大量共存的是
A. =0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- =0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- |
| B.0.1 mol/L AgNO3溶液:H+、K+、SO42-、I- |
| C.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
| D.甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- |
在无色透明的酸性溶液中,能大量共存的离子组是( )
| A.MnO4-、K+、SO42-、Na+ | B.Na+、SiO32-、K+、NO3- |
| C.NH4+、NO3-、Al3+、Cl- | D.K+、SO42-、HCO3-、Na+ |
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。分析其组成,现进行如下实验:
①取l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0. 03 mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0. 224L(假设丙全部逸出),最后沉淀完全溶解。下列推断正确的是
| A.肯定有K+、Al3+、Mg2+、SO42- |
| B.肯定有K+、NH4+、Al3+、SO42- |
| C.肯定没有K+、HCO3-、MnO4- |
| D.肯定没有K+、NH4+、Cl- |
在下列给定条件下的溶液中,一定能大量共存的离子组是
| A.无色溶液中:Ca2+、H+、Cl-、HCO3-、MnO4- |
| B.能使pH试纸呈红色的溶液中:Na+、NH4+、NO3-、I- |
| C.FeCl3溶液中:K+、Na+、SO42-、AlO2- |
D. 的溶液:Na+、K+、SiO32-、NO3- 的溶液:Na+、K+、SiO32-、NO3- |
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
| A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L |
| B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ |
| C.n(NH4+):n(Al3+):n(SO42-)=3:1:10 |
| D.原溶液一定存在Cl- |
有一无色透明的溶液,要确定是否含有以下离子:H+、K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊溶液 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤)。 。
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
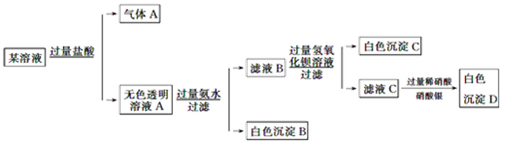
下列说法正确的是( )
| A.原溶液中一定存在AlO2-、CO32-、SO42-、Cl-四种离子 |
| B.原溶液中是否存在Na+无法判断 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓ |
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:__________________________。
在下列各溶液中,离子一定能大量共存的是( )
| A.强碱性溶液中:K+、Na+、Cl﹣、SO42﹣ |
| B.含有0.1mol•L﹣1Fe3+的溶液中:K+、Mg2+、SCN﹣、NO3﹣ |
| C.澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- |
| D.室温下,pH=1的溶液中:Na+、ClO-、NO3﹣、SO42﹣ |
溶液X中含有右表离子中的某5种,且其浓度均为 0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是
| 阳离子 |
阴离子 |
| Na+Ca2+ Fe2+Al3+ Fe3+ Mg2+ |
OH- HCO3-CO32-Cl-NO3- SO42- |
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤,剩余沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+一定存在,且c(K+)≥0.2mol ·L―1 |
| B.100 mL溶液中含CO32― 0.01mol |
| C.K+不一定存在 |
| D.Cl― 一定存在 |
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ=Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ=Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+=BaSO4↓ |
| D |
Na+、K+、ClOˉ、SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
某无色溶液,溶质仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:
⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
⑵在⑴所得溶液中加入过量溶液,有气体生成,同时析出白色沉淀甲;
⑶在⑵所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时析出白色沉淀乙。
则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+、CO32─ | B.Na+、CO32─、AlO2─ |
| C.CO32─、Na+、Al3+ | D.MnO4─、Na+、CO32─ |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |