常温下,若溶液中由水电离产生的 c(H+)=1×10-13 mol/L,满足此条件的溶液中,一定不能大量共存的离子组是( )
| A.K+、Na+、Cl-、HCO3- | B.Na+、Al3+、NO3-、SO42- |
| C.K+、Na+、Cl-、S2- | D.K+、NH4+、SO42-、NO3- |
下列各组离子能大量共存的是
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH4+、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+
④pH=2的溶液中:NH4+、Na+、Cl-、Cu2+
⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-
| A.③④ | B.①③ | C.①⑤ | D.②③ |
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。根据上述实验事实推断,在该溶液中肯定存在的离子组是( )
| A.Na+、Br-、CO32- | B.Na+、 I-、SO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、Br-、CO32- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.无色溶液中:K+、Fe3+、SO42-、H+ |
| C.c (H+)/c (OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断不正确的是:
| A.溶液中共发生了1个氧化还原反应 |
| B.反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ |
| C.有胶状物质生成 |
| D.溶液颜色发生变化 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
| A.①③⑤ | B.②④ | C.②⑤⑥ | D.④⑤ |
下列离子组在指定溶液中能大量共存的是
| A.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3- |
| B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
| C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变红的溶液中:NH4+、Mg2+、SO42-、NO3- |
| B.1.0 mol•L-1FeCl3溶液中:Na+、Cl-、NO3-、SCN- |
| C.1.0 mol•L-1KNO3溶液中:Fe2+、H+、Cl-、SO42- |
| D.与Al反应能放出H2的溶液中:Na+、Cl-、HCO3-、SO42- |
下列溶液中的离子一定能大量共存的是( )
| A.含大量MnO4-的溶液中:Na+、K+、Cu2+、Fe3+ |
| B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| C.酸性溶液中:Ba2+、NO3-、K+、AlO2- |
| D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN- |
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
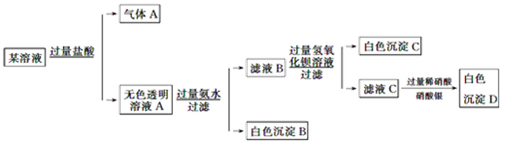
下列说法正确的是( )
| A.原溶液中一定存在AlO2-、CO32-、SO42-、Cl-四种离子 |
| B.原溶液中是否存在Na+无法判断 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓ |
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:__________________________。
在下列各溶液中,离子一定能大量共存的是( )
| A.强碱性溶液中:K+、Na+、Cl﹣、SO42﹣ |
| B.含有0.1mol•L﹣1Fe3+的溶液中:K+、Mg2+、SCN﹣、NO3﹣ |
| C.澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- |
| D.室温下,pH=1的溶液中:Na+、ClO-、NO3﹣、SO42﹣ |
溶液X中含有右表离子中的某5种,且其浓度均为 0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是
| 阳离子 |
阴离子 |
| Na+Ca2+ Fe2+Al3+ Fe3+ Mg2+ |
OH- HCO3-CO32-Cl-NO3- SO42- |
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤,剩余沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+一定存在,且c(K+)≥0.2mol ·L―1 |
| B.100 mL溶液中含CO32― 0.01mol |
| C.K+不一定存在 |
| D.Cl― 一定存在 |