下列说法正确的是v( )
| A.盐溶液都是中性的 |
| B.盐溶液的酸碱性与盐的类型无关 |
| C.NaHCO3溶液显酸性 |
| D.碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-盐酸 与b mol·L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是
A.混合液中:c(H+ ) ≤ |
| B.混合液中:c(NH3·H2O)+c(NH4+)=0.5a mol·L-1 |
| C.a = b |
| D.混合液中:c(H+)+c(NH4+)= c(OH-)+c(Cl-) |
下列水解的离子方程式正确的是
A.S2﹣+2H2O H2S+2OH﹣ H2S+2OH﹣ |
B.Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
C.HCO3﹣+H2O CO32﹣+H3O+ CO32﹣+H3O+ |
D.HS﹣+H2O H2S↑+OH﹣ H2S↑+OH﹣ |
25℃时,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
| A.①④ | B.①② | C.②③ | D.③④ |
下列各组离子中,因相互促进水解,而不能大量共存的是
| A.Al3+、SO42-、CO32-、Cl- |
| B.Na+、HCO3-、AlO2-、Cl- |
| C.H+、HS-、Na+、SO32- |
| D.OH-、Na+、K+、HCO3- |
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为
| A.0.15 mol·L-1 | B.0.2 mol·L-1 |
| C.0.3 mol·L-1 | D.0.4 mol·L-1 |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 | B.加热氯化铁溶液颜色变深 |
| C.铁在潮湿的环境下生锈 | D.浓硫化钠溶液有臭味 |
下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3- +H2O H3O++CO32- H3O++CO32- |
B.H2SO3的电离方程式H2SO3 2H++SO32- 2H++SO32- |
C.CO32-的水解方程式:CO32- +2H2O H2CO3+2OH- H2CO3+2OH- |
D.CuSO4的水解方程式: Cu2++2H2O Cu(OH)2+2H+ Cu(OH)2+2H+ |
下列化学用语正确的是
A.NaHCO3的水解:HCO3-+H2O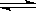 H3O++CO32- H3O++CO32- |
B.醋酸铵的电离:CH3COONH4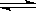 CH3COO-+NH4+ CH3COO-+NH4+ |
| C.H2的燃烧热为285.8kJ/mol:H2(g)+ 1/2O2(g)=H2O(g);△H=-285.8kJ/mol |
D.碳在高温下还原二氧化硅 SiO2+2C Si+2CO↑ Si+2CO↑ |
向浓度为0.1 mol·L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是
| A.H2O | B.CO2 | C.KHSO4固体 | D.KOH固体 |