下列有关溶液中粒子浓度的关系式中,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
常温下,0.1 mol/L氨水溶液中 =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是
| A.该溶液中氢离子的浓度:c(H+ ) = 1×10-9 mol/L |
| B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中: c(NH4+ ) + c(H+ ) = c(Cl- ) + c(OH-) |
| C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中: c(NH4+ ) + c(NH3) + c(NH3·H2O) = 2c(SO42-) |
| D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |
c(NH4+ )> c(NH3·H2O) > c(Cl-) > c(OH-) > c(H+ )
常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
常温下,关于下列各溶液的叙述正确的是
| A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D.已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)] |
Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:

(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
A、C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为 (填A或B),阴极反应式为 。
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是。
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
| A.溶液的pH=5时,硫元素的主要存在形式为HSO3- |
| B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) |
C.向pH=8的上述溶液中滴加少量澄清石灰水, 的值增大 的值增大 |
| D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na2CO3)<c(CH3COONa)<c(NaOH)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO﹣)+2c(OH﹣)=2c(H+)+c(CH3COOH)
D.0.1mol•L﹣1的NaHA溶液,其pH=4:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
已知HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
物质的量浓度相同的下列溶液中:①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3c(NH)由大到小的顺序是( )
| A.⑤②③①④ | B.④①③②⑤ | C.③②①⑤④ | D.③②④①⑤ |
物质的量浓度相同(0.1mol/L)弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是 ( )
| A.c(Na+)+c(H+)=c(X﹣)+c(OH﹣) |
| B.c(HX)+c(X﹣)=2c(Na+) |
| C.若溶液显酸性,则有:c(X﹣)>c(Na+)>c(HX)>c(H+)>c(OH﹣) |
| D.若溶液显碱性,则有:c(Na+)>c(HX)>c(X﹣)>c(OH﹣)>c(H+) |
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是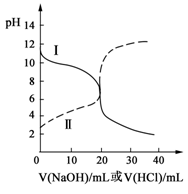
| A.曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH−)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则c(M+)=c(A-)
D.0.1 mol/L的 NaHA 溶液pH=1则c(Na+)=c(H2A)+c(HA-)+c(A2-)