若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
某溶液经检测只含有NH4+、Cl-、H+、OH-四种离子,
(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。
(2)若该溶液呈中性,则溶液中c(NH4+) c(Cl-)(填“>”、“<”或“=”),此时溶液中的溶质有 。
(3)若该溶液由0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合而成,则溶液中四种离子的浓度由大到小的顺序为 。
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:C(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
| B.0.1 mol/L NH4Cl溶液:C(NH4+ )=C(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:C(Na+)>C(NO3-) |
(14分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________mol/L;c(OH-)-c(HA)=________mol/L。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(5)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列________(填序号)。
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是( )
| A.c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + c (C2O42-) |
| B.c (HC2O4-) + c (C2O42-) =" 0.01" mol·L-1 |
| C.c (C2O42-) < c (H2C2O4) |
| D.c (K+) =" c" (H2C2O4) + c (HC2O4-) + c (C2O42-) |
常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
| A.若混合溶液的pH=7,则c1V1>c2V2 |
| B.若V1=V2,c1=c2,则溶液中c (NH4+) =c (Cl-) |
| C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-) |
| D.若V1=V2,且混合液的pH<7,则可能有c1 = c2 |
室温下,有关①100 mL 0.1 mol/L NaHCO3、②100mL 0.1 mol/L Na2CO3两种溶液的叙述错误的是( )
| A.两溶液中水的电离度比较:②>① |
| B.分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大 |
| C.①溶液中: c(CO32-) < c(H2CO3) |
| D.②溶液中: c(HCO3-) < c(H2CO3) |
已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。
请回答下列问题。
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
① ;② ;③ 。
(2)用离子方程式表示CH3COONa溶液显碱性的原因: ;
(3)当该溶液中溶质为两种,且溶液呈碱性时,四种离子的物质的量浓度由大到小的排列顺序可能为(写出两种):① 、② ;
(4)当溶液中各离子浓度大小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,则该溶液可能是 (填序号)。
A.由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.由0.1mol/L的CH3COONa溶液与0.1mol/L的NaOH溶液等体积混合而成
C.由0.1mol/L的CH3COONa溶液与0.1mol/L的CH3COOH溶液等体积混合而成
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
| A.若pH>7时,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH 7 (填>、<、=);
(4)将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
一元强酸HA的水溶液在加适量碱MOH后,溶液呈中性,下列判断中一定正确的是
| A.加入碱过量 | B.生成的盐不水解 |
| C.酸与碱等物质的量混合 | D.反应后溶液中c(A-)=c(M+) |
常温下,两种溶液:①0.1 mol/L HAC ②0.1 mol/L NaAC。
(1)溶液①的pH 7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是 。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。其原因是 (用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为 (填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:① ②(填“=”或“>”或“<”)
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。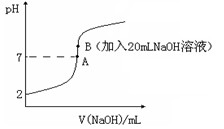
已知:电离度(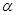 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[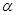 (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ (保留两位有效数字),电离度 约为___ _%。
约为___ _%。
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(1) △H=-a kJ•mol -1;
HF(aq)  H+(aq)+F-(aq) △H=+b kJ•mol -1
H+(aq)+F-(aq) △H=+b kJ•mol -1
则该过程中和反应的热化学方程式为:________________________________ ;在忽略F-水解的情况下,反应达到B点时,滴加过程中所释放的热量为________kJ(用只含a、b的式子表示)。
(4)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)="0.2" mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: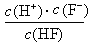 = Ka(HF)
= Ka(HF)
(12分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
⑴SnCl2用盐酸而不用水直接溶解的原因是 ,加入Sn粉的作用是 。
⑵反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
⑶检验沉淀已经“漂洗”干净的方法: 。
⑷反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH 。已知:Ksp[Sn(OH)2]=1.0×10—26。
⑸酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式:
。
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.pH=5的NaHSO3溶液中:c(HSO3—)>c(H2SO3)>c(SO32—) |
| B.使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH―)>c(H+) |
| C.在0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-c(OH-) |
| D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中: |
c(Na+)=c(CH3COO-)+c(CH3COOH)