使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)用 取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的 (填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为 mL。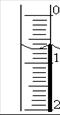
(4)滴定。当 时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
| 滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量= g/100mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.29 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
1.00 |
27.31 |
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后 再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(10分)已知草酸晶体( )可溶于水,并可与酸性高锰酸钾溶液完全反应:
)可溶于水,并可与酸性高锰酸钾溶液完全反应:
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
| |
第一次滴定 |
第二次滴定 |
第三次滴定 |
| 待测溶液体积(mL) |
25.00 |
25.00 |
25.00 |
| 标准溶液体积(mL) |
9.99 |
10.01 |
10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在 (填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是 (填序号)。
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是 。
(4)根据上述数据计算X= 。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 ;
②若KMnO4标准溶液浓度偏低,则X值 。
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项
| |
锥形瓶中的溶液 |
滴定管中的溶液 |
选用指示剂 |
选用滴定管 |
| A |
碱 |
酸 |
石蕊 |
(乙) |
| B |
酸 |
碱 |
酚酞 |
(甲) |
| C |
碱 |
酸 |
甲基橙 |
(甲) |
| D |
酸 |
碱 |
石蕊 |
(乙) |
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装1.00mol/L盐酸标准液。下图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积 25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
酚酞 |
| 变色范围(pH) |
5.0—8.0 |
3.1—4.4 |
8.2—10.0 |
该实验不可选用 作指示剂;若使用酚酞做指示剂滴定终点为__________________
③有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
20 |
0.50 |
25.12 |
24.62 |
| 2 |
20 |
如图 |
如图 |
填写_______ |
| 3 |
20 |
6.00 |
30.58 |
24.58 |
(2)根据所给数据,计算出烧碱样品中NaOH的物质的量浓度 mol/L
(3)下列几种情况会使测定结果偏高的是
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
e.未用标准液润洗酸式滴定管
阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00 mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2—3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下。 |
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写) 。
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点?
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”) 。
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管 (选填“甲”或“乙”)中。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定
值 (选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L-1(2分)。
16.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的五处错误。
① ,② ,③ ,
④ ,⑤ 。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
| A.移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时,反应容器摇动太激烈,有少量液体溅出 |
| D.滴定到终点时,滴定管尖嘴悬有液滴 |
E.读数(滴定管)开始时仰视,终点时俯视
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度(保留四位小数) mol/L
实验室中有一未知浓度的稀盐酸,某学在实验室中进行测定盐酸浓度的实验,请完成下列填空。
(1)配制100 mL 0.10 mol·L-1 NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶,贴上标签。
②托盘天平称量 g氢氧化钠固体。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度/(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积/mL |
待测盐酸的体积/mL |
| 1 |
0.10 |
22.58 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
用0.2000mol/L NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(A)移取15.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准NaOH溶液润洗碱式滴定管2-3次
(C)把盛有标准溶液的滴定管固定好,使滴定管尖嘴充满溶液
(D)取标准溶液注入滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下各空:
(1)正确操作的顺序是B→_____→_____→_____→A→F;
(2)三次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
19.95 |
则该盐酸溶液的准确浓度为_____________ mol/L。(保留小数点后4位)
(3)用标准的NaOH溶液滴定未知浓度的盐酸,下列情况可能造成测定结果偏高的是: 。
A.配制标准溶液时称量的氢氧化钠固体中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 |
待测溶液的体积(mL) |
0.100 0 mol·L-1NaOH的体积(mL) |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积(mL) |
||
| 第一次 |
20.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
20.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
20.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
(10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol・L-1的盐酸和0.1mol・L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol・L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol・L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol・L-1盐酸和0.1mol・L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
| A.50mL、50mL | B.100mL、100mL |
| C.100mL、150mL | D.250mL、250mL |
(4)写出有关的化学方程式_____________________ 。
某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(3)判断到达滴定终点的实验现象是 。
某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 |
草酸的体积(mL) |
温度/℃ |
其他物质 |
| |
2 mL |
20 |
|
| |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| |
2 mL |
30 |
|
| ④ |
1 mL |
20 |
1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
(8分)阅读下列实验内容,根据题目要求回答问题。
实验室中有一未知浓度的稀盐酸,某学生用0.100mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 |
20.00 |
0.10 |
24.18 |
| 2 |
20.00 |
0.10 |
23.06 |
| 3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失