硫酸和盐酸混合溶液20mL,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生下图所示的变化。
⑴开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵在A点溶液的pH是多少?
已知氢氧化钠和氢氧化钡混合溶液的 PH =" 14," 现取 100mL该混合溶液, 加入100mL0.4mol/LH2SO4溶液时生成的沉淀已达最多(溶液的体积变化忽略不计), 计算回答下列问题:(无计算过程不得分)
(1)原混合溶液中氢氧化钠和氢氧化钡的物质的量浓度为多少?
(2)反应后所得溶液的PH为多少?
列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合溶液为中性,且a=12,b=2,求Va∶Vb。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb。
Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L—1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要 。
(2)需准确称取Na2S2O3固体的质量为 g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉 淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。(写出具体计 算过程)
算过程)
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示。求:
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2)在B点时的pH是多少?(已知lg2=0.3)(无计算过程不得分)
在100mL 2mol/L的Ba(OH)2溶液中滴加100mL NaHSO4溶液,测得溶液的pH为1,求产生的沉淀的质量?
(8分)有PH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:
(1)当滴到沉淀不再增加时,溶液的PH(设体积可以加和)(已知lg2==0.3)
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度。
25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。
(1)若所得溶液的pH=11,且a=13,b=2,则Va︰Vb= 。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4 (填“可”或“否”)
(3)为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg 。
。
25℃时,若溶液呈中性,则AG= ,溶液的pH与AG的换算公式为AG= (要简化)。
(l)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为 。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol·L-1硫酸铝溶液
②0.1mol·L-1氯化钡溶液③蒸馏水④0.1mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是 。(用序号填写)
(3)常温下,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数 = mol·L-1。
= mol·L-1。
常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 ml和pH=3的某一元弱酸HA溶液20ml恰好完全反应生成NaA。试求:
(1)NaOH溶液的物质的量浓度
(2)此一元弱酸的物质的量浓度
(3)求此条件下该一元弱酸的电离平衡常数
(1)室温下,pH=13的NaOH 溶液与pH=2的HCl 溶液混合所得溶液的pH=7,求强碱溶液与强酸溶液的体积比?
(2)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合所得溶液的pH=11,求强碱溶液与强酸溶液的体积比?
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求: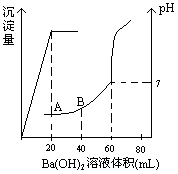
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2) 在B点时的pH是多少?(已知lg2=0.3)
(无计算过程不得分)