下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+) =c(HCO3-)+2c(CO32-)+c(OH-) |
| D.等V、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-) |
0.1 mol/L NaOH溶液140mL与0.1 mol/L H2SO4 60mL充分混合,若混合前后总体积变化忽略不计,则混合后溶液的pH为
| A.2 | B.3 | C.12 | D.9 |
相同温度下,相同物质的量浓度的下列溶液:
①CH3COONa、②NH4Cl、③Na2SO4、④NaHSO4、⑤NH3·H2O,
按pH由大到小顺序排列正确的是
| A.⑤①③②④ | B.④②③①⑤ | C.①⑤③②④ | D.①⑤③④② |
下列叙述正确的是
| A.用MgCl2·6H2O制取无水MgCl2时需在HCl气流中进行 |
| B.高锰酸钾溶液可用碱式滴定管盛装 |
| C.Al Cl3溶液蒸干可得到Al Cl3固体 |
| D.碳酸钠溶液的试剂瓶不能是玻璃瓶,可以用玻璃塞 |
在水中加入下列哪种物质或进行哪项操作,不会使水的电离平衡发生移动的是
| A.加入NaOH | B.加入CH3COONa | C.加入NaCl | D.升温 |
常温下有以下体积相同的四种溶液:①pH=3的CH3COOH溶液②pH=3的盐酸③pH=11的氨水④pH=11的NaOH溶液。下列说法正确的是
| A.②和③混合,所得混合溶液的pH大于7 |
| B.③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ |
| C.①与②分别与足量镁粉反应,生成H2的量:①<② |
| D.若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
下列实验误差分析错误的是
| A.用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B.用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
C.测定中和反应的反应热时,将碱分多次倒入酸中,所测 偏小 偏小 |
| D.酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |
40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如下图所示。下列说法不正确的是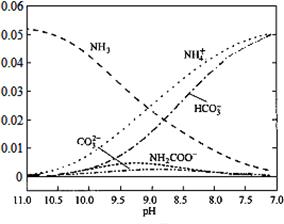
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入,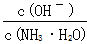 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
有关pH计算结果一定正确的是
①强酸pH=a,加水稀释到10n倍,则pH=a+n
②弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7)
③强碱pH=b,加水稀释到10n倍,则pH=b-n
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7)
| A.①② | B.②③ | C.③④ | D.②④ |
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将①④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| C.将四份溶液分别稀释到原体积相同倍数后,溶液的pH:③>④,②>① |
| D.将②③混合,若pH=7,则消耗溶液的体积:②>③ |
常温下pH为2的盐酸,下列叙述正确的是
| A.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010∶1 |
| B.向该溶液中加入等体积pH为12的氨水恰好完全中和 |
| C.将10 mL该溶液稀释至100 mL后,pH小于3 |
| D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol·L-1的NaOH溶液或0.10mol·L-1的稀氨水滴定得右图。下列说法正确的是
| A.由图可知曲线c为NaOH滴定硫酸 |
| B.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 |
| C.曲线b、c的滴定实验可用酚酞做指示剂 |
| D.由图可知滴定前醋酸电离度约为1.67﹪ |
下列说法正确的是
| A.室温下用广范pH试纸测得某氯水的pH=4 |
| B.酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 |
| C.若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 |
| D.酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |