用1.0mol·L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示。则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)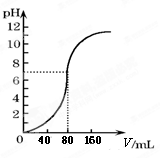
| A.0.5mol·L-1 160mL |
| B.1.0mol·L-1 160mL |
| C.0.5mol·L-1 80mL |
| D.1.0mol·L-1 80mL |
常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
| A.pH=12的Ba(OH)2 | B.pH=12的氨水 |
| C.0.05moL/L BaCl2 | D.0.01mol/L NaOH |
25℃时,水的电离达到平衡:H2O  H++OH- ,下列叙述正确的是
H++OH- ,下列叙述正确的是
A. 表示的粒子不会对水的电离平衡产生影响 表示的粒子不会对水的电离平衡产生影响 |
B. 表示的物质加入水中,促进水的电离,c(H+)增大 表示的物质加入水中,促进水的电离,c(H+)增大 |
C.25℃时, 表示的微粒加入水中,促进水的电离,KW不变 表示的微粒加入水中,促进水的电离,KW不变 |
| D.水的电离程度只与温度有关,温度越高,电离程度越大 |
室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列对于反应溶液pH的判断,正确的是
| A.若x=y,且a+b=14,则pH>7 |
| B.若10x=y,且a+b=13,则pH=7 |
| C.若ax=by,且a+b=13,则pH=7 |
| D.若x=10y,且a+b=14,则pH>7 |
25℃时,0.1 mol/L的某一元酸HA溶液中c(H+)/c(OH-)=l×l06.下列叙述正确的是
A.该溶液中由水电离出的c(H+)=l×10-13 mol/L
B.由pH=4的HA与pH=10的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH一)>c(H+)
C.浓度均为0.1 mol/L的HA和NaA溶液等体积混合,若所得溶液呈酸性,则:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol/L HA溶液与0.05 mol/L NaOH溶液等体积混合后,所得溶液中:c(H+)+c(Na+)=c(OH-)+c(A-)
用1.0 mol·L-1的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积关系变化如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是
| A.1.0 mol·L-1,20 mL | B.0.5 mol·L-1,40 mL |
| C.0.5 mol·L-1,80 mL | D.1.0 mol·L-1,80 mL |
10.下列各组离子中,能在指定溶液中大量共存的是
①无色溶液中:K+、Cl-、Na+、HCO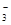 、OH-
、OH-
②使pH试纸变深蓝色的溶液中:K+、CO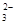 、Na+、AlO
、Na+、AlO
③由水电离出的c(H+)=10-12 mol·L-l的溶液中:ClO-、HCO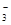 、NO
、NO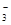 、NH
、NH
④加入Mg能放出H2的溶液中:Mg2+、NH 、Cl-、Na+、SO
、Cl-、Na+、SO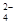
⑤使甲基橙变红的溶液中:MnO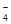 、NO
、NO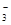 、SO
、SO 、Na+、Fe3+
、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO .Cl-、SO
.Cl-、SO
| A.①③ | B.②④⑤ | C.①②⑤ | D.③⑥ |
下列说法正确的是
| A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变 |
| B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用 |
| C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) |
D.常温下0.1mol·L-1的HA溶液中 ,则0.01 mol·L-1HA溶液中c(H+)=1×10-4mol·L-1 ,则0.01 mol·L-1HA溶液中c(H+)=1×10-4mol·L-1 |
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
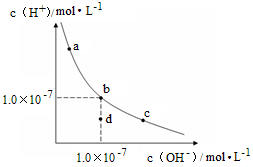
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
常温下,下列各组离子在相应的条件下可能大量共存的是
| A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ |
B.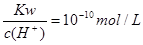 的溶液中:Na+、HCO3-、Cl-、K+ 的溶液中:Na+、HCO3-、Cl-、K+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- |
| D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
| A.试样中加入酚酞作指示剂,用标准酸液进行滴定 |
| B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 |
| C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行测定 |
| D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定 |
40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如下图所示。下列说法不正确的是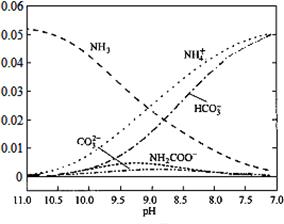
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入,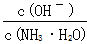 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol•L-1 |
| B.b点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,容易温度略下降的主要原因是NH3•H2O电离吸热 |
下列有关说法不正确的是
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B.上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应