25℃时,将氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
| A.[NH4+]=[SO42-] | B.[NH4+]>[SO42-] |
| C.[NH4+]<[SO42-] | D.[OH-]+[SO42-]=[H+]+[NH4+] |
下列溶液一定呈中性的是
| A.pH=7的溶液 |
| B.使石蕊试液呈紫色的溶液 |
| C.c(H+)=c(OH-)=10-6 mol/L的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
某学生用碱式滴定管量取0.1 mol•L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为( )

| A.大于10.00mL | B.小于10.00mL |
| C.等于10.00mL | D.不能确定 |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
在渔业生产中,有时需要异地运输鱼苗,为保证运输过程中鱼苗不死亡,必须满足下列条件:(1)水的pH要调在8~8.5之间;(2)防止细菌大量繁殖;(3)水中要溶有充足的氧气;(4)使鱼苗呼出的CO 2 气体及时排出。在长距离储运鱼苗的水中,最好加入下列物质中的
| A.纯净的氧气 | B.过氧化氢 | C.过氧化钠 | D.过氧化钙 |
下列比较中,正确的是( )
| A.同温度同物质的量浓度时,HF比HCN易电离,NaF溶液的pH比NaCN溶液大 |
| B.0.2 mol ·L-1NH4Cl和0.1 mol·L-1 NaOH溶液等体积混合后: c(NH4+)>c(Cl—)>c(Na+)>c(OH-)>c(H+) |
| C.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+)由大到小的顺序是:①>②>③>④ |
| D.物质的量浓度相等的H2S和NaHS混合溶液中: |
c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3·H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO-)之和始终保持不变 |
| D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. <1.0×10-7 mol/L <1.0×10-7 mol/L |
| B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C.c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| D.c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成的混合溶液。下列有关推断正确的是
A.若HA的电离能力大于A-的水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若A-的水解能力大于HA的电离能力,则有c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
(1)用pH试纸测得溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置后,CCl4层呈橙色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是
| A.肯定含有的离子是③④⑤ | B.肯定没有的离子是②⑤ |
| C.可能含有的离子是①⑥ | D.不能确定的离子是③⑥ |
下列有关说法正确的是
| A.催化剂可以加快化学反应速率,也能增大化学反应的焓变 |
| B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
C.25 ℃下,在NH3·H2O稀溶液中加水稀释, 的值不变 的值不变 |
| D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度减小 |
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O  H2SO3 + OH- ①
H2SO3 + OH- ①
HSO3- H+ + SO32- ②
H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
| A.加入少量固体NaOH,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
| B.加入等体积等浓度Na2SO3溶液,则3c(Na+) = 2[c(HSO3-) + c(H2SO3) +c(SO32-)] |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
| D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-) |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度则 =2时,若两溶液同时升高温度则 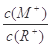 增大 增大 |