常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是
| A.VNaOH=10mL时,溶液中存在C(Na+)=2C(H2T)+2C(H T—)+2C(T 2—) |
| B.VNaOH=20mL时,溶液中存在C(Na+)>C(HT—)>C(H+)>C(H2T)>C(T 2—) |
| C.VNaOH=30mL时,溶液中存在C(Na+)>C(HT—)>C(T 2—)>C(OH—)>C(H+) |
| D.VNaOH=40mL时,溶液中存在C(OH—)=C(HT—)+2C(H2T)+C(H+) |
用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2溶液体积(V)间的关系图正确的是
叠氮酸(HN3)与醋酸的酸性相似,下列叙述中错误的是
| A.HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-) |
| B.若HN3比HCN酸性强,则相同体积相同物质的量浓度的NaN3与NaCN溶液中,离子总数NaN3比NaCN多 |
| C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
| D.HN3与NH3作用生成的叠氮酸铵是共价化合物 |
V mL密度为ρ g·mL-1的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶
质的质量分数为w%,物质的量浓度为c mol·L-1,那么下列关系式正确的是( )
A.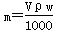 |
B.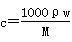 |
C.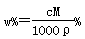 |
D.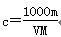 |
将质量分数为a%的NaOH溶液蒸发掉m g水后,变成VmL2a%NaOH不饱和溶液,则蒸发后溶液的
物质的量浓度是( )
A. mol/L mol/L |
B. mol/L mol/L |
C. mol/L mol/L |
D. mol/L mol/L |
下列关于配制一定物质的量浓度的溶液说法正确的是( )
| A.把40gNaOH溶解于1L水中即得到1mol/L的的NaOH溶液 |
| B.将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液 |
| C.配制0.2mol/L的的CuSO4溶液480mL,需硫酸铜晶体的质量为25g |
| D.配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高 |
三种正盐的混合溶液中含有0.2mol K+、0.25mol Zn2+、0.4mol Cl-和SO42-,则SO42-的物质的量为( )
| A.0.1mol | B.0.15mol | C.0.3mol | D.0.5mol |
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中一定正确的是 ( )
| A.A酸比B酸的电离程度小 |
| B.A是强酸,B是弱酸 |
| C.pH=1时,B酸的物质的量浓度比A酸大 |
| D.将pH=1的A酸和B酸稀释成pH=5的溶液,A酸所需加入的水量多 |
下列叙述中,正确的是( )
| A.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 |
| B.1mol/L0.5L的 AlCl3溶液中,阳离子的物质的量大于0.5mol |
| C.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 |
| D.在由水电离出的c(H+) = 1×10-12mol/L的溶液中,K+、ClO-、SO42-一定能大量共存 |
下列事实不可以证明乙酸是弱酸的是( )
| A.乙酸溶液的导电性比盐酸溶液的弱 |
| B.0.1mol/L乙酸钠溶液的pH约为8 |
| C.把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 |
| D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
将1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。此时若移走0.5molO2和0.5molSO2,则反应达到新的平衡时,SO3的物质的量为( )
| A.0.3 mol | B.0.15 mol | C.大于0.15mol,小于0.3mol | D.小于0.15mol |
常温下,0.1mol/LCH3COOH溶液中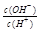 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
| A.溶液中水电离出的c(H+)=10-10mol/L |
| B.该溶液中醋酸的电离度为1% |
| C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| D.溶液中c(H+)+c(CH3COO-)=0.1 mol/L |
室温下pH、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加水稀释2倍后,两溶液的pH均减小 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.加等量的水稀释后,醋酸溶液的pH较盐酸小 |
| D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多 |
室温时,下列溶液混合后,pH大于7的是
| A.0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合 |
| B.0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合 |
| C.pH=3的硫酸和pH=11的氨水等体积混合 |
| D.pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合 |