已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
已知在酸性条件下有以下反应关系:
①KBrO3能将I-氧化成KIO3,本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
向KBrO3溶液中滴加少量KI的硫酸溶液后,所得产物除水外还有
| A.Br-、I2 | B.Br2、IO |
C.Br2、I2、IO |
D.Br2、Br-、I2 |
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是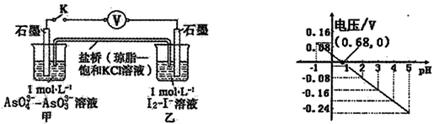
A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。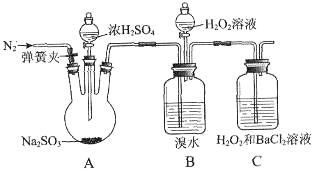
| 实验操作 |
实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 |
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 |
C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是________________________________________。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是____________。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br― 观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是___________________________________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是________。
下列反应的离子方程式正确的是 ( )
| A.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+ H2O |
| B.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C.向100mL 1mol/L FeBr2溶液中通入0. 5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3 + 3H+=Fe3+ + 3H2O |
根据下列框图,有关说法正确的是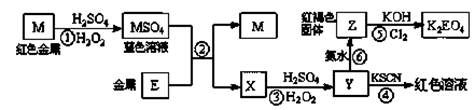
| A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O ==3EO4 2―+ 6Cl― +12H+ |
| C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
| D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42―+4H2O+3e-=E(OH)3+5OH― |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法制备中,每生成1 molNa2FeO4,共转移4 mol电子 |
| C.湿法制备中,每生成1 mol Na2FeO4,,共转移3 mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去等H2S、NH3,并使悬浮杂质沉降 |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
① 氧化剂是H3AsO3 ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol; ④ M为OH-; ⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是( )
| A.Na2O2在反应中只作氧化剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2是还原产物 |
| D.2mol FeSO4发生反应时,反应中共有8mol电子转移 |
计算题(共16分,写出计算过程)
1). 在标准状况下,224mL某气体的质量为0.40 g。试计算这种气体的摩尔质量。
2). 0.5L1 mol/L的CaCl2溶液,与多少L的0.5 mol/L AlCl3的Cl-的物质的量相等?
3). 若需要2.0 mol/LCuSO4溶液100 mL,配制此溶液应称取CuSO4·5H2O的质量是多少? (已知:CuSO4·5H2O的摩尔质量为250g/mol,CuSO4·5H2O ==CuSO4 + 5H2O)
4).在Cu + 2H2SO4(浓) △CuSO4 + SO2↑ + 2H2O中
①氧化剂是 ,氧化产物
②还原剂和氧化剂的物质的量之比是 ;还原性强弱比较:Cu SO2 (填>或<)。
③若反应中消耗2mol Cu,则反应中转移 mol电子。
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操 作 |
现 象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH |
pH试纸变红(约为4) |
 |
ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
| 试管 |
操作 |
现象 |
结论 |
| a |
取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
|
Cl2的氧化性强于Fe3+ |
| b |
取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 |
CCl4层没有明显变化 |
|
| c |
|
CCl4层由无色变为橙黄色 |
Cl2的氧化性强于Br2 |
强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3
FeCl3
B.Fe+I2 FeI3
FeI3
C.Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2
CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2
FeCl2+Br2
F.FeI2+Br2 FeBr3+I2
FeBr3+I2