高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O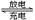 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
关于该电池的说法正确的是
| A.放电时,Zn作负极,发生还原反应 |
| B.放电时,K2FeO4附近溶液pH减小 |
| C.充电时,锌极附近溶液pH减小 |
| D.充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O |
.减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为 。
②电化学降解NO 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g
(2)在完全放电耗尽PbO2和Pb时,若按图连接
则电解一段时间后,在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
| A.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
| B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池内部H+由正极向负极移动 |
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: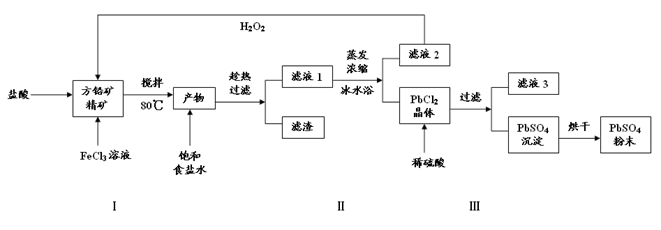
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,
则:N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。
① NO与CO混存时,相互反应的化学方程式为 。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为 。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在 K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的 极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为 。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为 。
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为 。
二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源。工业上利用煤的气化产物(水煤气)合成甲醇和二甲醚。回答下列问题:
(1)制备二甲醚最后一步反应由Al2O3催化甲醇脱水合成,反应方程式为 。
(2)已知:CO(g)+2H2(g)=CH3OH (g) △H= —90.1kJ·mol-1 CO(g)的燃烧热是282.8 kJ·mol-1;H2的燃烧热是285.8 kJ·mol-1写出表示CH3OH (g) 燃烧热的热化学反应方程式 。
(3)二甲醚直接燃料电池比甲醇直接燃料电池更高效,等质量的二甲醚和甲醇完全放电转移电子的物质的量之比是 。用二甲醚直接燃料电池电解足量饱和食盐水,当消耗9.2g二甲醚时理论上阴极产生的气体的体积为 L。(标况下)
(4)在合成中伴有水煤气交换反应:CO(g)+H2O(g)  CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
| 温度 |
260℃ |
280℃ |
295℃ |
310℃ |
| CO转化率 |
89% |
80% |
75% |
60% |
①请解释CO转化率随温度变化的关系 。
②列式计算280℃时平衡常数 。
③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使温度 (填“升高”、“降低”、“不变”)
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下: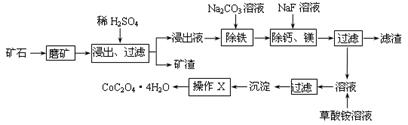
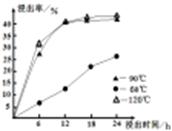
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____=□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+  VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
| A.每消耗1molCH4可以向外电路转移4mol电子 |
| B.负极上CH4失去电子,电极反应式为CH4+10OH—=CO32—+7H2O+8e— |
| C.负极上是O2获得电子,电极反应式为:O2+2H2O+4e—=4OH— |
| D.电池放电后,溶液pH不断升高 |
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)反应①为__________(选填“吸热”或“放热”)反应。
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构如下图:
以下选项两栏内容正确且相关联的是
| 选项 |
操作与现象 |
解释与推论 |
| A |
电池放电时化学能转化为电能 |
Zn(s) + Cu2+(aq) = Zn2+ + Cu(s) △H>0 |
| B |
该电池充电时铜棒变细 |
两电极区溶液颜色都变深 |
| C |
该电池放电时铜棒是电池正极 |
Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D |
该电池充电时a接电源正极 |
电极反应Cu2++2e- = Cu |