新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )

A.电极B为正极,纳米MnO2层的作用是提高原电池的工作效率
B.放电过程中,Na+从正极区向负极区迁移
C.电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol
通过NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法不正确的是
| A.Pt电极是该装置的正极 |
| B.正极的电极反应式:O2 + 4e−+ 2H2O=4OH− |
| C.负极的电极反应式:NO−2e−+O2−=NO2 |
| D.固体电解质中O2−向负极移动 |
甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H

已知:在25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式 .
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:
0~10min 内,氢气的平均反应速率为 mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号) .
| A.v正(CH3OH)=3v逆(H2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为 极,负极反应式为 .在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为 mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H 0(填“>”、“<”或“=”).
已知某碱性硼化钒(VB3)一空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.若B装置内的液体体积为400mL,则CuSO4溶液的物质的量浓度为0.025mol/L |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.外电路中电子由a电极流向b电极 |
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。

铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行: Pb+PbO2+2H2SO4  2PbSO4+2H2O, 有关该电池的说法正确的
2PbSO4+2H2O, 有关该电池的说法正确的
| A.放电时,电解质溶液的pH不断降低且正负极均有PbSO4生成 |
| B.放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 |
| C.充电时,阳极反应:PbSO4 +2e- = Pb + SO42- |
| D.充电时,铅蓄电池的负极与外接电源的负极相连 |
铁是用途最广泛的金属材料之一,但生铁易生锈,请讨论电化学实验中有关铁的性质。
(1)某原电池装置如图所示,右侧烧杯中的电极反应为_________,左侧烧杯中的c(Cl-)________(填“增大”“减小”或“不变”)。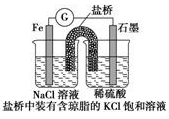
(2)已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(3)用高铁酸盐设计的高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式________________________________。
②用高铁电池做电源,以铁为阳极,以铜作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2________L。(标准状况)
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )

| A.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3mol H2O2,转移的电子为3mol |
| D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
下列叙述错误的是( )
| A.氢氧燃料电池是一种将化学能转化为电能的装置 |
| B.铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 |
| C.钢铁腐蚀时负极的电极反应式:Fe-3e-=Fe3+ |
| D.工业上电解饱和食盐水时阴极的电极反应式:2H++2e-=H2↑ |
近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O 2 →2CO 2+ 3H2O.下列说法不正确的是( )
A.1mol乙醇被氧化转移6mol电子
B.C2H5OH在电池的负极上参加反应
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应式为4H++O2+4e-=2H2O
如图为某种甲醇燃料电池示意图,工作时电子移动方向如图所示,下列判断正确的是( )

| A.X为氧气 |
| B.电极A反应式:CH3OH-6e-+H2O=CO2+6H+ |
| C.B电极附近溶液pH增大 |
| D.电极材料活泼性:A>B |
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
| A.a为CH4,b为CO2 |
| B.CO32-向负极移动 |
| C.此电池在常温时也能工作 |
| D.正极电极反应式为O2+2H2O+4e-="==" 4OH- |
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应SO2(g)+NO2(g)  SO3(g)+NO(g),测得上述反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
SO3(g)+NO(g),测得上述反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
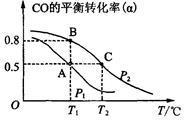
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。A、B两点对应的压强大小关系是PA PB(填“大于”、 “小于”或“等于”)。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
(1)已知:①C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) ΔH="-2220.0" kJ·mol-1
②H2O(l)==H2O(g) ΔH="+44.0" kJ·mol-1
写出丙烷燃烧生成CO2和气态水的热化学方程式:______________________。
(2)航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。我国发射的“神舟五号”载人飞船是采用先进的甲烷电池为电能来源,该电池以KOH溶液为电解质。试回答:
①负极上的电极反应为________________________________;
②消耗标准状况下的5.6 L O2时,有________mol电子发生转移。
③开始放电时,正极附近溶液的pH________(填“增大”“减小”或“不变”)。