21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流,新研制的某汽油燃料电池的一个电极通入空气,另一个电极通入汽油蒸气,用NaOH溶液作电解质溶液。填写下列空格。
(1)汽油_____________(选填“有”或“没有” )固定的熔沸点。炼制汽油的原料是石油,工业上生产汽油的常用方法是 。(填序号)
①分馏 ②干馏 ③裂化 ④聚合
(2)汽油中有一种烃的成分为 ,它的分子式是 ,名称是 。
,它的分子式是 ,名称是 。
(3)汽油燃料电池的能量转换形式是将 能直接转化为 能。通入空气的那个电极是燃料电池 极(选填“正”或“负”)。若汽油的组成用上述烃的分子式表示,则负极的电极反应式为 。
请按要求回答下列问题:
(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:_________________________。
(2)惰性电极电解饱和Na2S溶液时,在阳极附近没有看到预期的浑浊现象,探究发现,其生成了Na2Sx,则阳极反应式为:_____________________。当阳极产生1mol Sx2-时,阴极产生的气体在标准状况下的体积为_________L。(用含x的代数式表示)
(3)合成氨工业中,天然气能代替煤用于生产原料气——H2,且反应类似。请写出天然气转化为H2的两步反应方程式:______________________________________,
___________________________________________。
(4)已知:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
HCN |
5×10-10 |
| H2CO3 |
Ka1 = 4.2×10-7 |
HClO |
3×10-8 |
| Ka2 = 5.6×10-11 |
①上述四种酸中,酸性最强的是 ;
②25℃时,0.01 mol/L NaCN溶液的pH________7;
③在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
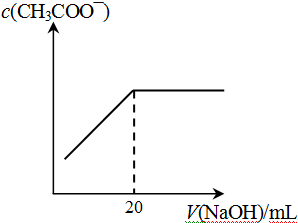
④25℃时,向20mL 0.1 mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图像正确的是_____________。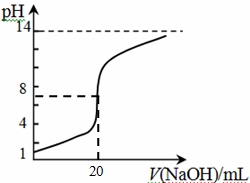

A B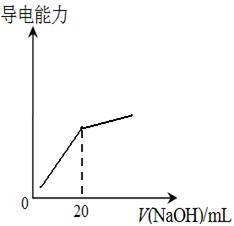
C D
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.下图是一个电化学过程的示意图.

已知甲池的总反应式为:2CH3OH+3O2+4KOH K2CO3+6H2O 请填空:
K2CO3+6H2O 请填空:
(1)充电时:①原电池的负极与电源______极相连,②阳极的电极反应为________.
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2____L(标准状况下).
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
(1)今有2H2+O2  2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
(2)若把KOH溶液改为稀H2SO4作电解质,则电极反应式为
正极: ;负极: ;
(1)和(2)的电解质不同,反应后,其溶液的pH各有什么变化? ;
(3)若把H2改为CH4,用KOH溶液作电解质溶液,则负极的电极反应式为 。
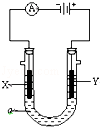
(共10分前2个空每空一个1分,其余每空2分)依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示:
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为___________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为_________________________________________;
电池正极发生的电极反应为______________________________________;
有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Y的原子结构示意图为 ,YW2的结构式为 。
(2)将X2、W2按下图所示通人某燃料电池中,其中,b电极的电极反应式为 。

若有16gW2参加反应,转移的电子是 NA。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为 。
(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
(1)101KPa时,1mol气态CH3OH完全燃烧生成CO2气体和液态水时,放出726.51kJ的热量,则甲醇燃烧的热化学方程式是 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O (g)═CO2(g)+3H2(g);△H1═+49.0KJ•mol﹣1
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g);△H2═?
O2(g)═CO2(g)+2H2(g);△H2═?
已知H2(g)+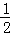 O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
(3)一种甲醇燃料电池是采用铂或碳化钨作电极,稀硫酸作电解液,一极直接加入纯化后的甲醇,同时向另一个电极通人空气.则甲醇进入 极,正极发生的电极反应方程式为 .
(1)今有2H2+O2 =2H2O反应,构成碱性KOH燃料电池,则负极电极反应式为 ,正极电极反应式是 。
(2)若把KOH改为稀H2SO4作电解质,则负极电极反应式为 ;正极电极反应式为 。(1)和(2)的电解质不同,反应进行后,其溶液的pH个有什么变化? 。
(3)若把H2改为CH4,用KOH作电解质,则负极电极反应式为 ;正极电极反应式为 。
(1)已知甲烷燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O这个电极是燃料电池的 (填“正极” 或“负极”),另一个电极上的电极反应式为:
(2)已知吸热反应2HI(g) ===H2(g) + I2(g)吸收热量11kJ,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(1)已知甲烷燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O这个电极是燃料电池的 (填“正极” 或“负极”),另一个电极上的电极反应式为:
(2)已知吸热反应2HI(g) ===H2(g) + I2(g)吸收热量11kJ,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________。
(2)若电解质溶液为硫酸,其正极反应为______________________,
负极反应为___ ______________。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算:
①电解池阳极生成氯气的物质的量是 mol。
②氢氧燃料电池中转移的电子数目是 个
消耗H2的质量是 g。(写出计算过程)(保留2位小数)
(10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为: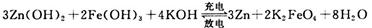
放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
(9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。