根据铜锌原电池示意图,回答下列问题: 
(1)锌为 极,电极反应式为 ;铜为 极,电极反应为 ,原电池总离子反应式是 。
(2)若以该电池作为电源,以石墨碳棒为电极电解CuCl2溶液,在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”);电子从电池的锌极沿导线流向电解池的 (填“阴极”或“阳极”,下同);在电解池中Cu2+向 移动,在该电极上析出铜的质量为 g。
碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1) NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L—1的氨水,溶液中随着水量的增加而减小的是_____________(填序号)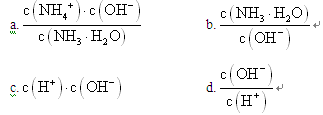
(2)标准状况下,将1.12LCO2通入100mL1mol·L—1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为_________________________________________________;
①c(OH—)=2c(H2CO3)+______________________________________________;
②c(H+)+c(Na+)=___________________________________________________。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则 原电池工作时电解质溶液中向正极移动的离子是_____________。
原电池工作时电解质溶液中向正极移动的离子是_____________。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
下图为氢氧燃料电池的示意图:
⑴若以稀硫酸为电解液,则a极为___ _极。
⑵若以KOH溶液作电解液,则b极上的电极反应式为_______________________,放电一段时间后电解液的pH将________(填“变大”、“变小”或“不变”)。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,3.20gN2H4在氧气中完全燃烧生成氮气,放出热量62.4kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。负极的电极反应式是 _ _。
(3)下图是一个电化学过程示意图。
①锌片上 发生的电极反应是 。
发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)。
(4)传统制备肼的方法是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
请按要求写出下列反应方程式:
(1)请写出下列溶液水解(或双水解)的离子反应方程式:
①次氯酸钠溶液:
②泡沫灭火器工作原理:
③氯化铁溶液与偏铝酸钾溶液混合:
(2)请写出酸性条件下氢氧燃料电池的电极反应方程式:
负极:
正极:
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”);
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为 ,
检验该电极反应产物的方法是
(4)写出装置甲的反应总化学方程式 。
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.AgNO3 | D.AlCl3 |
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。请回答下列问题。
(1)W的原子结构示意图为 。能说明Z的非金属性比X的金属性强的事实是 (举一例)。
(2)W、Y和氢可形成原子个数比为1:1:4的化合物,工业酒精中含有此物质。该化合物的一个重要作用是用作燃料电池,如图是2004年批量生产的以该物质为燃料的燃料电池结构示意图。则a通入的物质为 ,B电极反应式为 。
(3)电解NaZ水溶液时,阴极的电极反应式为 。工业上,用上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为 。
(4)已知:298K时,金属钠与Y2气体反应,生成1 mol Na2Y固体时,放出热量414 kJ;生成1 mol Na2Y2固体时,放出热量511 kJ。由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 。
以煤为主要原料可以制备乙二醇,相关工艺流程下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式____________________
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 ____(填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH4。)与C02反应制备合成气。已知:
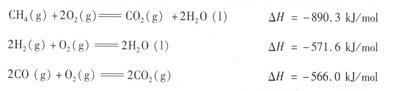
则CH4与CO2生成合成气的热化学方程式为
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
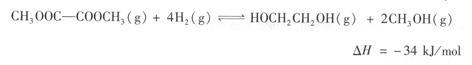
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:

①草酸是二元弱酸,可以制备 (草酸氢钾),
(草酸氢钾), 溶液呈酸性,用化学平衡原理解释: 。
溶液呈酸性,用化学平衡原理解释: 。
②在一定的 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
A.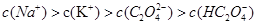
B.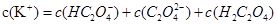
C.
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的 (填“正”或“负”)级,负极反应式为 。
微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体,将有机物的化学能转化为电能。以葡萄糖溶液作底物为例,其工 作原理如右图所示。
作原理如右图所示。
 已知石墨电极上反应为:
已知石墨电极上反应为:
C6H12O6+6H2O-24e- 6CO2+24H+
⑴ 电池中的质子交换膜只允许质子和水分子通过。电池工作时,质子移向电源的 极,铂碳上所发生的电极反应式为_____________。
⑵燃烧热是指1摩尔物质完全燃烧生成稳定的物质(如H转化为液态水,C转化为二氧化碳 )所放出的热量。葡萄糖的燃烧热为2800kJ/mol,写出葡萄糖燃烧的热化学方程式 。
⑶ 化学需氧量(COD)是重要的水质指标,其数值表示将1L水中的有机物氧化为CO2、H2O所需消耗的氧气的质量。科学家设想利用微生物燃料电池来处理某些污水,并进行发电,该设想已经在实验室中获得成功。但如果1L废水中有机物(折算成葡萄糖)氧化提供的化学能低于5.6kJ,就没有发电的必要。则下列污水中,不适合用微生物燃料电池发电的是 (填序号)。
| 序号 |
A |
B |
C |
D |
E |
| 污水类型 |
生活污水 |
印染 |
电镀 |
造纸 |
硫酸工业废水 |
| COD值(mg/L) |
520 |
870 |
20 |
960 |
120 |
下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
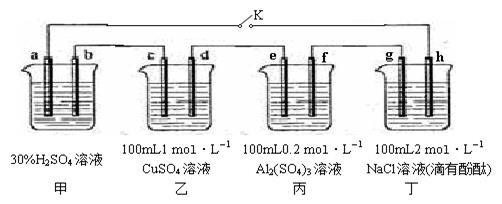
(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量
是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。
(7分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是_________________热反应,这是由于反应物的总能量____________生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量_______________________形成产物的化学键放出的总能量。
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2 g氢气燃烧时放出286 kJ热量,而每千克汽油燃烧时放出的热量为46000 kJ。试据此分析氢气作为能源代替汽油的优势:_______________________________。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是____________ (填“a电极”或“b电极”),在负极发生的电极反应是_________________,