燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:_________________
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变);
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的一种化合物的一种用途 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。常温下该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。
(4)W(s)+O2(g) WO2(g); H1 W(g)+O2(g)
H1 W(g)+O2(g) WO2(g); H2
H2
则 Hl (填“>”或“<”或“=”)
Hl (填“>”或“<”或“=”) H2。
H2。
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
(6)若将V金属投入到硫酸溶液中,生成了浅绿色溶液N。写出N的溶液与K2Cr2O7酸性溶液反应的离子方程式: 。
(16分)运用化学原理知识研究化学对于人类的生产生活、科研意义重大。
(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜。CuFeS2中Fe的化合价为_____,熔炼过程中所得炉渣的主要成分有FeO、Fe2O3、SiO2,Al2O3等,若要利用炉渣制取铁红,下列实验操作不需要的是_____(填写字母代号)。
| A.溶解 | B.过滤 | C.蒸发结晶 | D.灼烧 |
(2)Mg(OH)2是水垢的主要成分之一,用氯化铵溶液浸泡:可以溶解Mg(OH)2,请结合平衡移动原理解释其原因_____。
(3)研究发现CuCl2溶液中铜、氯元素的存在形式为Cu(H2O)42+、CuCl42-,电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,阴极析出红色物质,试计算该过程中共转移电子____mol,若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入________。
(4)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2。其工作原理如图所示。电池放电时Na+由____(填写“a”或“b”,下同)极区移向___________极区,该电池的负极反应式为__________________________________。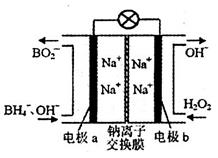
(13分)有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30)。A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)H元素在周期表中属于 区。G的基态原子电子排布式为 CD2中C的杂化类型是___________
(2)下列说法不正确的是 。
a.B2A2分子中含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.A2D2分子的空间构型为直线形
d.B、C、D的电负性由大到小的顺序为D>C>B
e.B、C、D的第一电离能由大到小的顺序为D>C>B
f.H2+能与BD分子形成[H(BD)4]2+,其原因是BD分子中含有空轨道
g.B和G的单质能形成相同类型的晶体,其熔点B > G
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中。晶胞如图所示,该晶体的化学式为___________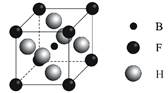
(4)CD2、D2和熔融ECD3可制作燃料电池,其原理如下图所示。该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为___________
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:
N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。
(1)实验室中常用来制备氨气的化学方程式为 。
(2)已知H2(g)的燃烧热为285.8kJ•mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式 _。
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________________(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为_____________mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)。
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2 ]:CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
30 |
70 |
80 |
100 |
| n(CO2)/mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20min时v正(CO2)_________80min时v逆(H2O)(填“>”、“=”或“<”)。在t℃时,该反应的平衡常数K= 。
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将_________(填“增大”、“不变”或“减小”)。
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是 (填图甲中的“A”或“B”)。
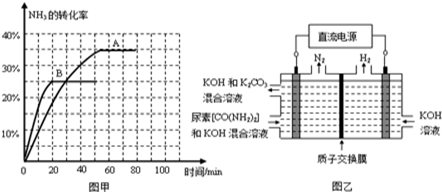
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气。该装置中阳极的电极反应式为______ ,若两极共收集到气体22.4L(标况),则消耗的尿素为______g(忽略气体的溶解)。
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用下图实验装置(两电极均为石墨电极)电解 溶液来制取
溶液来制取 、
、 、
、 和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为 ,此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的 溶液从出口 (填“A”、“B”、“C”或“D”)导出。
溶液从出口 (填“A”、“B”、“C”或“D”)导出。
(3)利用制得的氢气为基本原料合成出甲醇,然后再用甲醇与氧气、氢氧化钠组成燃料电池,则该电池负极的电极反应式为 。
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为 。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
SO42- |
| c/mol·L-1 |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为 L。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为 ,该过程中被氧化的元素是_____ ,当产生标准状况下2.24 L CO2时,共转移电子 mol。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
| A.容器内混合气体颜色不再变化 |
| B.容器内的压强保持不变 |
| C.v逆(NO2)=v正(NO) |
| D.容器内混合气体密度保持不变 |
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
下面是某课外小组从初选后的方铅矿【主要成分PbS,含少量黄铜矿(CuFeS2)中提取硫磺、铜、铅的工艺流程: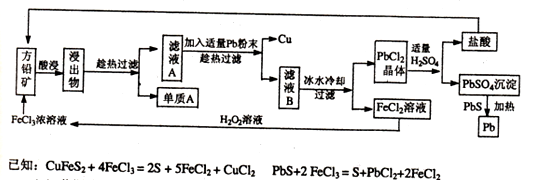
(1)黄铜矿(CuFeS2 )中Fe元素的化合价为 ,提高方铅矿酸浸效率的措施有 (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ;单质A是 ;在此工艺操作中可循环利用的物质有铅和
(3)在酸性的FeC12溶液中加入H202溶液,其反应的离子方程式为 。
(4)PbS04与PbS加热条件下反应的化学方程式为. .将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化为PbCO3,写出该反应的平衡常数表达式:K= 。(己知Ksp(PbSO4)="1.6x" 10-5,Ksp(PbC03)=3.3x10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸。铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4 2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
近来,制备和利用氢气这一清洁能源已有多项成果。
(1)德国克莱斯公司成功研制了甲醇(CH3OH)制氢车载燃料电池工艺,其原理如下流程图所示:

①流程图中,甲醇与水在选择氧化器中反应生成二氧化碳和氢气,写出该反应的化学方程式
②该车载燃料电池的介质为碱性环境,请写出该燃料电池的正极反应式为
(2)美国Bay等工厂成功研制了以甲烷来制取氢气,其生产流程如下图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式K=
H2(g)+CO2(g),该反应的化学平衡常数表达式K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如下表,在830 ℃、以表中的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
| 实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
③若400 ℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2kJ,第Ⅰ步反应的热化学方程式为:CH4(g) + H2O(g) === 3H2(g) + CO(g) ΔH=-103.3 kJ·mol-1则400 ℃时,甲烷和水蒸反应生成二氧化碳和氢气的热化学方程式为:
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,下图是三种催化剂在光照分解水实验中的效果比较图。

要得出如图所示的实验结果,需要测定的实验数据是 ,本实验的目的是 。
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.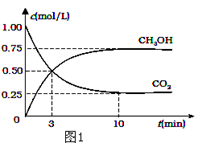
(1)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min);
②氢气平衡时的物质的量浓度为___________;
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________.
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol CO2和3mol H2 |
④当反应达到平衡时, H2的物质的量浓度为c1,然后向容器中再加入1mol CH3OH和1mol H2O,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1______c2的关系(填>、<、=).
(2)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答: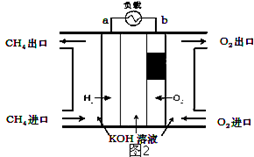
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率___________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。
I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4 2PbSO4+2H2O,请根据上述情况判断:
2PbSO4+2H2O,请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:
请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验: 在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=" -" 49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=" -" 49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率
v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 |
| D.再充入1molCO2和3molH2 |
④在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________________。
⑤我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。写出该电池负极的电极反应式__________________________。