实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-= PbSO4+2e-
正极:PbO2+4H++SO42-+2e-= PbSO4+2H2O
今若制得Cl2 0.10 mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.025 mol | B.0.050 mol | C.0.10 mol | D.0.20 mol |
下图是一种新型的镁电池,因其成本低,电流强度大备受关注。该电池的总反应是:Mg+FeSO4 MgFeSO4在放电过程中a极质量会增加,下列说法正确的是
MgFeSO4在放电过程中a极质量会增加,下列说法正确的是
| A.放电时,电子从b极通过电解质流向a极 |
| B.放电时,没转移0.2mol电子,消耗2.4g的Mg |
| C.电解质是含镁离子的水溶液 |
| D.充电时,b极上的电极反应式为:Mg2++FeSO4+2E=MgFeSO4 |
“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应。其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用。下图为镍氢电池构造示意图(氢化物电极为储氢金属,可看做H2直接参加反应)。下列说法正确的是
| A.充电时阴极区电解质溶液pH降低 |
| B.在使用过程中此电池要不断补充水 |
| C.放电时NiOOH在电极上发生氧化反应 |
| D.充电时阳极反应为Ni(OH)2-e-+OH- = NiOOH+H2O |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极 表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图。下列有关说法正确的是
| A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L |
| B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D.d电极上发生的电极反应是:O2+4H++4e-=2H2O |
下列有关说法正确的是
| A.铅蓄电池放电时,正极和负极的电极质量均增大 |
| B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0 |
| C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
| D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
下列叙述正确的是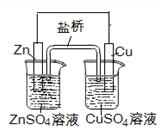
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.上图Zn为负极,发生还原反应 |
| C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是
| A.放电时负极反应为:Zn - 2e—+ 2OH— ="=" Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3 -3e— + 5OH— ="=" FeO42— + 4H2O |
| C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
下列有相关说法不正确的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.在任何条件下,纯水都呈中性 |
| C.水的离子积常数Kw随温度、外加酸(碱)浓度的改变而改变 |
| D.铅蓄电池充电时,标有“—”的电极应与电源的负极相连 |
下列说法正确的是
| A.氢氧燃料电池能量转换的主要形式为化学能转化为电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D.催化剂通过降低化学反应的焓变加快化学反应速率 |
下列有相关说法不正确的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.在任何条件下,纯水都呈中性 |
| C.水的离子积常数Kw随温度、外加酸(碱)浓度的改变而改变 |
| D.铅蓄电池充电时,标有“—”的电极应与电源的负极相连 |
微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为
Zn+2OH--2e-===ZnO+H2O
Ag2O+H2O+2e-===2Ag+2OH-
总反应式为Ag2O+Zn===ZnO+2Ag
根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH增大 |
| B.在使用过程中,电子由Ag2O经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn极发生还原反应,Ag2O极发生氧化反应 |
TESLA电动汽车的电池采用了松下提供的NCA系列(镍钴铝体系)的18650A型钴酸锂(LiCoO2)锂离子电池。电池正极材料为钴酸锂(LiCoO2),负极材料是石墨(C6)。电池反应为:LiCoO2+C6 C6Lix+Li1-xCoO2。下列有关说法不正确的是
C6Lix+Li1-xCoO2。下列有关说法不正确的是
| A.锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点 |
| B.废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收 |
| C.放电时,正极锂的化合价未发生改变 |
| D.充电时电池正极上发生的反应为:LiCoO2—x e-=Li1-x CoO2+xLi+ |