下列离子方程式正确的是
| A.氯气溶于水形成氯水:Cl2+H2O=2H++Cl-+ClO- |
| B.将FeO溶解于足量稀HNO3中:FeO+2H+=Fe2++H2O |
| C.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-=AlO2-+2H2O |
| D.SO2用过量NaOH溶液吸收:SO2+2OH-=SO32-+H2O |
下列各组物质在溶液中的化学反应,可用同一离子方程式表示的是
| A.盐酸与石灰石,盐酸与碳酸钠 |
| B.硝酸银与氯化钠,硝酸银与盐酸 |
| C.硝酸与氢氧化钠,硫酸与氨水 |
| D.硫酸铜与氢氧化钠,硫酸铜与氢氧化钡 |
下列离子方程式的书写正确的是
| A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3+ + H2O |
| B.将Na投入到CuSO4溶液:2Na+Cu2+=2Na++Cu |
| C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| D.SiO2与NaOH溶液反应:SiO2+2OH-=SiO32-+H2O |
在胶片冲洗时可用硫代硫酸钠(Na2S2O3)做定影液,与胶片上未曝光的AgBr反应生成可溶性离子Ag(S2O3)23-。该有关过程的离子方程式不合理的是
A.H2S2O3溶液显弱酸性的原因是:H2S2O3 H+ + HS2O3- H+ + HS2O3- |
B.Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O  H2S2O3 + 2OH- H2S2O3 + 2OH- |
C.Na2S2O3和AgBr反应的离子方程式是:2S2O32-+ AgBr  Ag(S2O3)23- + Br- Ag(S2O3)23- + Br- |
| D.定影不能在酸性较强的溶液中进行的原因是:S2O32-+ 2H+=" S↓+" SO2↑+ H2O |
下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- CO2 + H2O CO2 + H2O |
B.铁和稀硫酸反应:Fe + 2H+ H2 + Fe3+ H2 + Fe3+ |
C.向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- Al(OH)3¯ Al(OH)3¯ |
D.NaHCO3溶液与NaOH溶液反应:OH- + HCO3- CO32- + H2O CO32- + H2O |
铁、铝、铜都是中学化学常见的金属.
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为: 。
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为: 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 。
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,
4Fe+10HNO3="4" Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是 ,第二个反应每生成1molNH4NO3,被还原的硝酸的物质的量是 。
③如何检验NH4NO3溶液中的NH4+离子,请描述操作 ,写出相关的离子反应方程式 。
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入 。
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母) 。
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
能正确表示下列反应的离子方程式是: ( )
| A.硫酸铁与氢氧化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| B.钾和水反应 K+2H2O=K++2OH-+H2↑ |
| C.小苏打与烧碱溶液反应 HCO3-+OH-=CO32-+H2O |
| D.苏打与盐酸反应 HCO3-+H+=CO2↑+H2O |
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ=Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ=Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+=BaSO4↓ |
| D |
Na+、K+、ClOˉ、SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
无机化合物可根据其组成和性质进行分类:

(1)上述所示的物质分类方法名称是 。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、③和⑥后面。(每空填写一个化学式即可)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)二氧化碳与氢氧化钠溶液反应的离子方程式为____________。
(4)过氧化钠可作供氧剂,原因是_______(用化学方程式表示)。
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称____________,其水溶液显_______性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_____________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为__________________________。
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
| A.Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓ |
| B.NH4++Fe3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O |
| C.2Fe3++ SO42-+ Ba2++6OH-=BaSO4↓+ 2Fe(OH)3↓ |
| D.3NH4++ Fe3++3SO42-+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O |
下列反应的离子方程式正确的是
A 硫酸铜溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B 向三氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=A1(OH)3↓+3NH4+
C 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH—=CaCO3↓+H2O
D 石灰石溶于醋酸: CaCO3+2H+=Ca2++CO2↑+H2O
(1)FeCl3溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_____________(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)将氯化铝溶液蒸干灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
下列反应的离子方程式正确的是
| A.H2S通入CuSO4溶液中 S2- + Cu2+ = CuS↓ |
| B.AgCl投入KI溶液中 Ag+ + I- = AgI↓ |
C.Na2S的水解反应 S2- + 2H2O 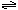 H2S + 2OH- H2S + 2OH- |
D.NH4NO3溶液呈酸性 NH4+ + H2O 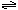 NH3•H2O + H+ NH3•H2O + H+ |